摘要
采用线性扫描伏安法和循环伏安法研究了304不锈钢在FeCl3酸性溶液中的腐蚀行为。结果表明:相同pH及Cl-浓度下,随着Fe3+浓度增加,304不锈钢自腐蚀电位正移,自腐蚀电流密度增加。304不锈钢在酸性Fe3+溶液中发生腐蚀时,由于Fe3+还原反应的存在导致不锈钢自腐蚀电位正移,从而使电极表面H+还原反应难以进行;当Fe3+含量充足时,不锈钢腐蚀过程中阴极反应主要为Fe3+还原反应,而不是H+去极化反应。因此在研究不锈钢点蚀行为时,要充分考虑到蚀孔周围Fe3+的作用。
关键词: 304不锈钢; 点蚀; 循环伏安曲线; 动电位极化; Fe3+还原
Abstract
The corrosion behavior of 304 stainless steel in acidic FeCl3 solution was studied by linear sweep voltammetry and cyclic voltammetry. The results show that the free-corrosion potential of 304 stainless steel shifts positively and the free-corrosion current density increases with the increase of Fe3+ concentration at the same pH and Cl- concentration. When 304 stainless steel is corroded in acidic Fe3+ solution, the free-corrosion potential of stainless steel is positively shifted due to the presence of Fe3+ reduction reaction, which makes it difficult for H+ reduction reaction to carry out on the electrode surface. When Fe3+ content is sufficient, the cathodic reaction in stainless steel corrosion process is mainly Fe3+ reduction reaction, not H+ depolarization reaction. Therefore, it should be fully considered the effect of Fe3+ on pits growth in the study of pitting corrosion behavior of stainless steel.
Keywords: 304 stainless steel; pitting corrosion; cyclic voltammetry; linear sweep voltammetry; Fe3+ reduction reaction
PDF (4237KB) 元数据 多维度评价 相关文章 导出 EndNote| Ris| Bibtex 收藏本文
本文引用格式
张浩, 杜楠, 周文杰, 王帅星, 赵晴。 模拟海水溶液中Fe3+对不锈钢点蚀的影响[J]. 中国腐蚀与防护学报, 2020, 40(6): 517-522 doi:10.11902/1005.4537.2019.145
ZHANG Hao, DU Nan, ZHOU Wenjie, WANG Shuaixing, ZHAO Qing. Effect of Fe3+ on Pitting Corrosion of Stainless Steel in Simulated Seawater[J]. Journal of Chinese Society for Corrosion and Protection, 2020, 40(6): 517-522 doi:10.11902/1005.4537.2019.145
304不锈钢由于具有优良的耐蚀性、良好的加工性能和力学性能,被广泛应用于航空航天等国防工业领域,但是在含有Cl-的溶液中容易发生点蚀[1]。点蚀是不锈钢失效的主要形式之一,具有口小孔深,不易发现的特点,隐蔽性极强,在生产应用中存在极大的安全隐患[2-4]。因此研究不锈钢点蚀的生长机理对于理解点蚀生长过程,预测和控制点蚀行为具有重要的理论和实际意义。
不锈钢在溶液中发生电化学腐蚀的根本原因在于溶液中含有使不锈钢氧化的氧化性物质,即腐蚀过程的去极化剂[5]。对于金属材料在溶液中的腐蚀而言,O2和H+是最常见的去极化剂,分别引起耗氧腐蚀和析氢腐蚀。
金属材料在海水溶液中发生析氢腐蚀还是发生耗氧腐蚀取决于溶液的pH和氧浓度[6-8]。Hu等[6]研究表明,Aermet100超高强度钢在溶液pH大于4.2时,主要发生耗氧腐蚀;当溶液pH低于2时,主要发生析氢腐蚀。刘淑云等[7]研究结果表明,X80钢在pH为5.5的溶液中,阴极反应主要为氧去极化反应。Wang等[8]研究表明,X80钢在酸性土壤中的阴极反应取决于溶解氧浓度和pH,在pH为4.0,氧浓度大于1.90 mg/L时,氧去极化反应为主要的阴极反应;当溶解氧浓度小于0.25 mg/L时,阴极反应以析氢反应为主。但是,对于不锈钢的点蚀而言,阴极反应变得极为复杂。
当不锈钢发生点蚀后,腐蚀产物在蚀孔周围富集并发生水解,导致蚀孔附近腐蚀环境恶化。Liu等[9]利用蚀孔周围pH降低这一现象原位检测Fe的局部腐蚀。研究人员[2,10]利用蚀孔周围腐蚀产物浓度变化原位监测蚀孔生长。必须指出,不锈钢的点蚀产物主要为Fe2+,由于Fe2+在溶液中不能稳定存在会转变为Fe3+,因此使用FeCl3溶液作为试验溶液研究不锈钢材料耐点蚀性能已经被广泛的接受[11-13]。例如,GB/T 17897-1999[14]中就是使用FeCl3溶液作为试验溶液评价不锈钢的耐点蚀性能。但值得注意的是,Fe3+不仅可以发生水解导致蚀孔周围溶液pH降低,也有可能发生还原反应,直接参与不锈钢点蚀的阴极过程。然而到目前为止,对于不锈钢点蚀过程中Fe3+还原反应发生的条件及其对不锈钢点蚀影响的研究还较少。
本文利用线性扫描伏安法得到304不锈钢在不同浓度Fe3+溶液中的腐蚀参数,利用循环伏安曲线得到0.1 mol/L FeCl3溶液中可能发生的阴极反应及其电位范围,结合热力学条件讨论腐蚀环境中Fe3+对不锈钢蚀孔生长的影响,以及不锈钢在Fe3+溶液中的腐蚀机理。
1 实验方法
1.1 实验材料及测试溶液
实验材料为304不锈钢,其化学成分 (质量分数,%) 为:C 0.035,Si 0.520,Mn 1.180,Po.036,S 0.026,Cr 17.590,Ni 8.030,Fe 72.600。将304不锈钢线切割成直径为10 mm的圆片作为工作电极,保留一侧表面为工作面,非工作面使用Cu导线焊接后用环氧树脂封装。电化学实验前将工作表面用砂纸逐级打磨至1200#,然后依次用酒精、丙酮擦拭,经去离子水清洗并吹干后,放入干燥皿中备用。
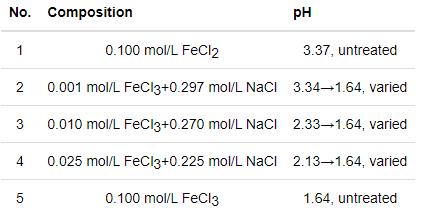
使用分析纯化学试剂和去离子水配制0.001,0.010,0.025和0.100 mol/L FeCl3溶液。为了排除Cl-浓度及溶液pH对不锈钢腐蚀行为的影响,通过添加NaCl试剂使不同浓度Fe3+溶液中的Cl-浓度维持在约0.3 mol/L。使用1 mol/L HCl溶液调节pH,使不同浓度FeCl3溶液的pH与0.100 mol/L FeCl3溶液的pH一致。配制0.100 mol/L FeCl2溶液作为对照,讨论蚀孔周围Fe2+转变为Fe3+对不锈钢腐蚀的影响。实验所用溶液如表1所示,溶液的pH使用Mettler FE20 pH计测量。
1.2 测试方法
电化学测试在Autolab PGSTAT 302N电化学工作站上进行,包括循环伏安曲线测试和动电位极化曲线测试。动电位极化曲线测试采用三电极体系,304不锈钢为工作电极,参比电极为饱和甘汞电极,辅助电极为Pt电极。进行电化学测试前,使用400~1200#砂纸逐级打磨试样,并在3.5% (质量分数) NaCl溶液中浸泡3 h,以使电极表面生成稳定的钝化膜。待试样的开路电位稳定后测量动电位极化曲线,扫描区间为-0.5~0.4 V,扫描速率为5 mV/s,结果取3次测量的平均值。测量结束后,用超声波和酒精清洗试样,然后用KH-7700型三维视频显微镜观察腐蚀形貌。
循环伏安曲线测试采用三电极体系,其中玻碳电极 (GCE,Φ=3 mm) 作为工作电极,参比电极为饱和甘汞电极,辅助电极为Pt电极。GCE使用前使用0.25 μm Al2O3抛光粉抛光,超声波清洗。循环伏安曲线测试中起始电位设置为开路电位 (OCP),最低电位为-0.8 V,最高电位为1.0 V,扫描速率为10 mV/s,从开路电位向低电位方向扫描,到达最低电位后再正向扫描,循环3次。
2 结果与讨论
2.1 Fe3+浓度对304不锈钢腐蚀行为的影响
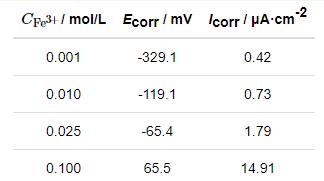
Fe3+具有较强的水解作用,不同浓度的FeCl3溶液pH不同,并且Cl-浓度也不同,这些都是影响不锈钢腐蚀的重要因素[15-18]。因此,为了得到Fe3+自身对不锈钢腐蚀的影响,实验过程中保持待测溶液具有相同的pH和Cl-浓度。配置不同浓度Fe3+溶液时,使用HCl溶液调节溶液pH相等,并通过添加分析纯NaCl试剂使溶液中Cl-浓度尽量相近。不同浓度Fe3+溶液中304不锈钢腐蚀的动电位极化曲线如图1所示,其拟合结果列于表2中。由图可知,当pH为1.64,Cl-浓度为0.3 mol/L时,随着Fe3+浓度的增加,304不锈钢自腐蚀电位不断正移,自腐蚀电流密度不断增加,同时阳极极化曲线上钝化区间不断缩小;当Fe3+浓度为0.1 mol/L 时,阳极极化曲线没有明显的钝化行为。这表明Fe3+对不锈钢腐蚀的加速作用不仅仅只是Fe3+水解促进腐蚀,Fe3+自身也可以促进腐蚀。
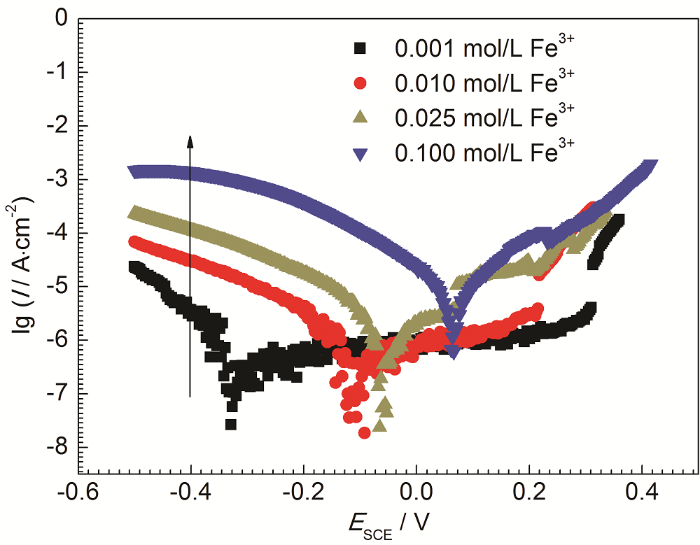
图1 304不锈钢在不同浓度Fe3+溶液中的动电位极化曲线 (pH=1.64,CCl?=0.3 mol/L)
Fig.1 Potentiodynamic polarization curves of 304 stainless steel in the solutions with different concentrations of Fe3+ (pH=1.64, CCl?=0.3 mol/L)
表2 304不锈钢在不同浓度Fe3+溶液中的动电位极化曲线拟合结果
动电位极化曲线测试结束后,观察试样表面形貌,并记录试样表面最大的点蚀孔,如图2所示。4组溶液中的试样表面均出现了点蚀孔,但是在高浓度的Fe3+溶液中试样表面的蚀孔数量更多,蚀孔尺寸 (以最大蚀孔尺寸为对比依据) 更大。在相同pH及相同Cl-浓度下,0.100 mol/L Fe3+溶液中试样表面最大蚀孔的直径约为55 μm,深度约为27 μm;而0.001 mol/L Fe3+溶液中试样表面所观察到的最大蚀孔直径约为31 μm,深度约为4 μm。这与电化学测试结果相互印证,表明Fe3+自身也可以加速不锈钢腐蚀。
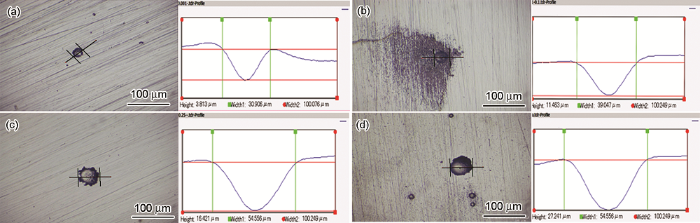
图2 304不锈钢在不同浓度Fe3+溶液中极化后的腐蚀形貌
由图1可知,随着Fe3+浓度增加,304不锈钢的阴极反应动力学参数有着明显的变化,表现为在相同电位下,阴极还原电流密度增加。如电位E=-0.4 V (SCE) 时,金属阳极溶解反应速度较小,可以认为此时发生单一电极反应:
(1)其逆 (氧化) 反应速率j←可以忽略不记,正 (还原) 反应速率j→为
(2)式中,n为反应中的电子数,F为Faraday常数,Af为指前因子,CO为氧化剂浓度,R为气体常数,T为绝对温度,E→θa为正 (还原) 反应活化能,α为传递系数,ΔE为电极电位差值。对于固定的电极反应而言,氧化反应速率与ΔE和CO有关。在溶液pH和溶解氧浓度基本不变的前提下,随着Fe3+浓度增加,304不锈钢的阴极电流密度增加,这表明Fe3+作为氧化剂参与了304不锈钢在不同浓度FeCl3溶液中的阴极反应,因此可以认为在本实验条件下304不锈钢腐蚀过程中必然存在Fe3+还原反应。
2.2 0.100 mol/L FeCl3溶液中的阴极反应及其电位范围
如前文所述,304不锈钢在0.100 mol/L FeCl3溶液中必然存在Fe3+还原反应,除此之外还可能发生析氢反应和吸氧反应,因此有必要使用循环伏安曲线研究0.100 mol/L FeCl3溶液中存在的阴极反应,以及各个阴极反应的电位范围。图3是玻碳电极在0.100 mol/L FeCl3溶液中的循环伏安曲线。可见,0.100 mol/L FeCl3溶液中的循环伏安曲线存在两个还原峰,分别在E=0.24 V (SCE) 和E=-0.3 V (SCE) 处,电流密度峰值分别为4.38和3.07 mA/cm2。根据氢去极化、氧去极化和Fe(III) 还原3种还原反应的热力学条件及特点判断,可以认为E=0.24 V (SCE) 对应着Fe3+还原为Fe2+的反应,E=-0.3 V (SCE) 处是H+还原反应的还原峰;而氧去极化反应受到溶解氧浓度的限制,还原电流较小 (仅为几百μA/cm2)[19],在循环伏安曲线中没有出现对应的还原峰。
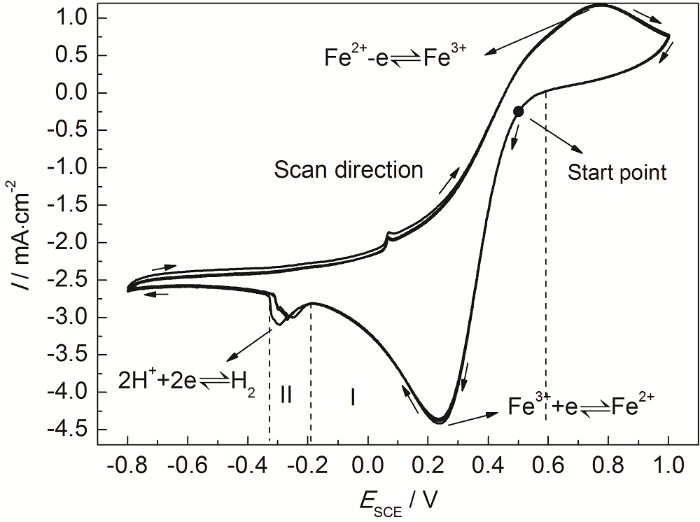
图3 玻碳电极在0.100 mol/L FeCl3溶液中的循环伏安曲线
玻碳电极具有化学稳定性高的特点,可以认为在0.100 mol/L FeCl3溶液中玻碳电极自身不发生电化学反应。由图3循环伏安曲线可见,当腐蚀电位小于0.59 V (SCE) 时 (区域I),电极表面开始发生阴极还原反应,根据热力学条件可以认为此时阴极反应包括氧去极化过程和Fe3+还原过程。随着电位降低,阴极还原电流持续增加,当电位E=0.24 V (SCE) 时,还原电流密度增加到4.38 mA/cm2,此时电极表面的还原反应以Fe3+还原为Fe2+为主,Fe3+还原反应达到极限电流密度。当电位负移至-0.19 V (SCE) 时,开始发生H+还原反应,使还原电流密度增加,并在E=-0.3 V (SCE) 时达到极值。
综上可知,当电位范围在-0.19~0.59 V (SCE) 之间时,溶液中阴极反应为氧去极化和Fe3+还原反应,不存在氢去极化反应;只有电位低于-0.19 V (SCE) 时,溶液中才有可能发生氢去极化反应。由图1可知,304不锈钢在0.100 mol/L FeCl3溶液中自腐蚀电位为0.065 V (SCE),不满足析氢反应的热力学条件,因此可以认为自然状态304不锈钢在0.100 mol/L FeCl3溶液中阴极反应主要为氧去极化和Fe3+还原反应。
2.3 Fe3+对不锈钢点蚀的影响
图4为304不锈钢在0.100 mol/L FeCl2溶液和0.100 mol/L FeCl3溶液中的动电位极化曲线。结果表明,当溶液中的Fe2+被Fe3+替代后,304不锈钢的自腐蚀电位由-475.1 mV (SCE) 正移至65.5 mV (SCE),而腐蚀速率也有显著增加。304不锈钢在以Fe2+为主的腐蚀环境中,根据溶液pH和溶解氧浓度的不同,阴极发生吸氧反应或者析氢反应。但是,如果溶液中存在Fe3+,由于Fe3+水解以及Fe3+还原将导致材料表面电极电位正移,使得析氢反应难以进行。这种变化对于理解不锈钢蚀孔生长机理将产生新的认识。
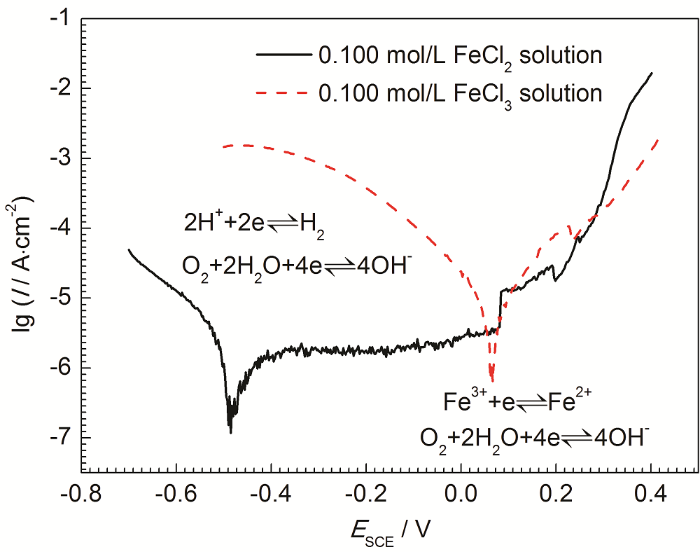
图4 304不锈钢在0.100 mol/L FeCl3溶液和0.100 mol/L FeCl2溶液中的动电位极化曲线
当不锈钢发生点蚀后,蚀孔内存在大量的Fe2+。艾莹珺[20]研究表明,304不锈钢蚀孔内总的铁离子浓度可以达到3.29 mol/L。由于蚀孔内具有较高的酸度[21],溶解氧不太可能扩散进蚀孔内使孔内Fe2+转变为Fe3+,并且孔内Fe3+也不能稳定存在[22]。但是孔内的Fe2+可以扩散到蚀孔外,并在孔外富集,这点也得到了实验的证实[2,10]。在孔外,溶解氧浓度较为充足,足以使Fe2+转变为Fe3+。
许多学者认为不锈钢发生点蚀时,阳极反应主要在蚀孔内进行,而阴极反应主要在蚀孔外进行[23-25]。也就是说,蚀孔生长过程中,阴阳极反应可以分别在蚀孔内外进行。如图5所示,孔内产生的Fe2+向蚀孔外迁移,Cl-等阴离子向蚀孔内迁移,孔内pH的降低和Cl-浓度的增加导致孔内金属溶解速度增加。孔外的Fe2+在溶解氧的作用下转变成Fe3+,产生的Fe3+在电极表面得到电子还原成Fe2+,而还原产生的Fe2+又与扩散来的溶解氧反应生成Fe3+,如此循环往复。
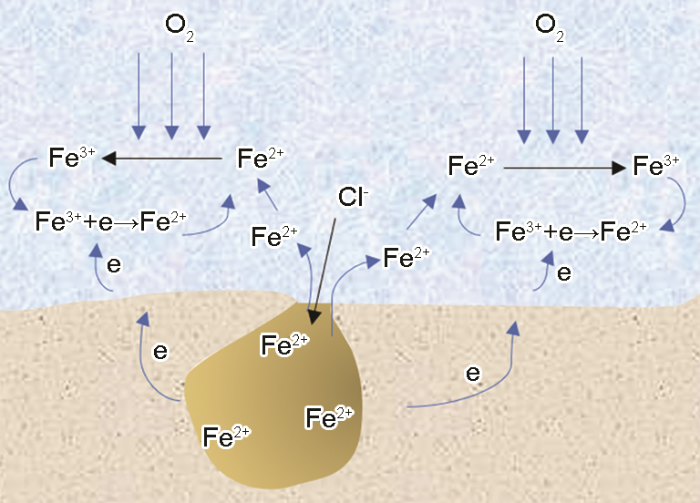
图5 蚀孔生长示意图
在这个过程中,蚀孔外的Fe3+是由溶液中的氧与孔内扩散出来的Fe2+反应生成,Fe3+在电极表面发生阴极还原反应又会转变为Fe2+,这个过程本质上是氧消耗电极表面的电子,而Fe3+只是在传递电子,但是这个过程使电子转移速度更快。溶解氧直接得电子发生还原反应只能发生在电极表面,而电极表面的阴极区是有限的,因此氧去极化反应会受到阴极面积以及氧扩散速度的限制。而Fe2+转变为Fe3+的过程不依赖于电极表面,在任何有溶解氧的区域都可以完成Fe2+向Fe3+的转变。考虑到Fe3+还原需要迁移到电极表面,可能只有在固/液界面附近生成的Fe3+才会参与电极反应。但即使如此,与Fe2+反应生成Fe3+的溶解氧数量也要远大于电极表面的溶解氧数量。此外,Fe3+的水解度也远大于Fe2+的,会导致蚀孔外pH更低。
不锈钢点蚀过程中蚀孔外溶解氧与Fe2+反应生成Fe3+,Fe3+在电极表面得到电子发生还原反应,导致材料表面电极电位正移,自腐蚀速率增加;而由于电极电位正移,导致电极表面析氢反应无法进行。
3 结论
(1) 304不锈钢在0.100 mol/L FeCl3溶液中的阴极反应主要为Fe3+还原。这是因为Fe3+可以使304不锈钢自腐蚀电位正移,从而导致H+还原反应无法进行。
(2) 当不锈钢发生点蚀后,蚀孔内的Fe2+向蚀孔外迁移,并与溶解氧发生反应生成Fe3+,产生的Fe3+可以在蚀孔外得电子发生还原反应,促进蚀孔生长。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。
相关文章

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414
点击排行
PPT新闻
“海洋金属”——钛合金在舰船的
点击数:7204
腐蚀与“海上丝绸之路”
点击数:5800





