1 阴极保护技术家族
中文名称:阴极保护技术
英文名称:Cathodic protection
定 义 1 :通过降低腐蚀电位获得防蚀效果的电化学保护方法。
应用学科:船舶工程(一级学科);
船舶腐蚀与防护(二级学科)
定 义 2 :将被保护金属作为阴极,施加外部电流进行阴极极化,或用电化序低的易蚀金属做牺牲阳极,以减少或防止金属腐蚀的方法。
应用学科:海洋科技(一级学科);
海洋技术(二级学科);
海水资源开发技术(三级学科)
定 义 3 :通过降低腐蚀电位而实现的电化学保护。
应用学科:机械工程(一级学科);
腐蚀与保护(二级学科);
电化学腐蚀(三级学科)
2 阴极保护技术史话
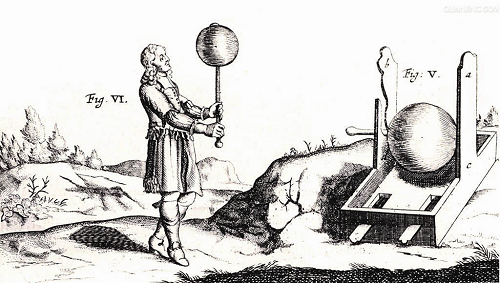
1834 年法拉第阴极保护原理奠定基础;1890 年爱迪生提出强制电流保护船舶;1902 年柯恩实现了爱迪生的设想;1905 年美国用于锅炉保护;1906 年,德国建立第一个阴极保护厂……
阴极保护技术及其原理论述是与电化学学科同步发展的,它的发展与工业需求和材料科学、电子学等技术进步息息相关。
1812 年
1812 年汉弗莱 . 戴维爵士提出假说——化学变化与电性质变化是同一的,至少它们都与物质的相同性质有关。他认为,通过改变物质的电性状态可以减小或增大化学反应动力。只有当物质具有不同的电荷时,它们才能化合。如果对一个原呈正电性的物质,人工地使它荷负电,那么它的键合力就受到干扰,也就不再能成为腐蚀的化合物了。在1812 年人们还不能从电化学方面诠释这些发现,所以戴维的关于改变物质负电性以控制腐蚀的论述是令人赞叹的。
戴维确认,铜在伽法尼电压的电动序中是一种较正电性的金属:当铜变成更为负电性(成为阴极)时,海水对它的腐蚀作用(化学变化)可被阻抑。为了能够解释其过程变化,戴维用略呈酸性的海水进行实验,把抛光的铜板浸入海水中,其中一块铜板上焊上一块锡。
三天后在无锡的铜板上产生了显著的腐蚀,而焊有锡块的铜板上则没有腐蚀现象。戴维由此得出结论,其他非贵金属(如锌或铁)也能产生这种保护作用。戴维在他的学生、助手米歇尔 . 法拉第的支持下进一步进行了试验。由此得出结论,在铜件上焊锌块对铜的防腐蚀是同样有效的。
在焊有一块铁板的铜板上,当与一块锌相连接时,不仅是铜,而且连同铁板都被保护了,免遭腐蚀。戴维在实验室的大量试验中发现,用锌或铁可对铜进行阴极保护。对于阴极保护技术发展来说,这是非常重要的实验发现。
1824 年
随后戴维把他的这一研究成果向英国皇家学会和英国海军部做了报告:
1824 年,他获得批准对木质战舰的铜包覆层开始实际试验。1824 年,他在“三宝垄”号快速炮帆船上做了进一步试验,这条船曾于 1821 年在印度用新的铜板镶装包覆。在该战舰的船首和船尾安装了铸铁板,其面积总计为船体铜表面积的 2%,此船做了一次开往加拿大NovaScotia 的旅行,于 1825 年返回。结果表明,除了船首部位由于海水涡流冲刷引起的一些侵蚀外,船体上未发生任何腐蚀损伤。随后他又在一些游艇和船上施加了阴极保护,同样获得了良好效果。
1826 年,戴维在研究报告的结论中指出:当浸入液体中的两种不同金属用导线连接成回路时,一种金属的腐蚀受到促进,而另一种金属的腐蚀则减慢,这就是铜船体通过连接铁块或锌块而受到保护的原因。戴维的许多实验研究及上述结论可认为是最早的阴极保护理论,1824 年这一年也就被后人列为阴极保护技术的开创年代。
1829 年
1829 年 5 月 29 日汉弗莱 . 戴维逝于日内瓦,著名科学家米歇尔 . 法拉第在随后几年中进一步研究了铸铁在海水中的腐蚀。他在 1833 年提出了著名的法拉第电解定律,于 1834 年发现了在腐蚀损耗与电流之间的定量关系。在题为“关于电的实验研究”的论文中,他首先提出了“电解质”“电极”“阳极”“阳离子”和“阴离子”等概念。他的科学研究和发现奠定了阴极保护原理。

1902 年
1902 年,科恩成功地将外加直流电流实际应用了阴极保护方法。
1906 年
1906 年,盖波特建成了第一个管道阴极保护站,用 10V/12A 的直流发电机通过辅助阳极对有轨电车线路影响范围内 300m 长的埋地煤气管道和供水管道实施阴极保护,并 1908 年 3 月 27 日获得第一个有关外加电流阴极保护的德国专利。
美国的卡姆博兰德于 1905 年就采用外加电流阴极保护方法来防止蒸汽锅炉及其管道系统的内腐蚀,但他获得德国专利的时间是 1911 年 9 月 28 日。
哈博和戈尔德施密特于 1906 年在德国煤气与供水工程师协会 DVCW 侣导下首次开展了对阴极保护科学原理的卓有成效研究。他们认为,阴极保护和杂散电流电解都是电化学过程。在“电化学杂志”上阐述了著名的测量电流密度的哈博方法、土壤电阻的测量以及管道/土壤电传的测量;哈博使用不极化的硫酸锌参比电极测量电位。
1908 年
1908 年,麦克考兰姆首次采用了至今仍在埋地结构物防腐蚀技术中普遍应用的硫酸铜参比电极来测量电位。
1913 年
1913 年秋在日内瓦金属研究所举行的一次大会上,人们已经把牺牲阳极的保护命名为“电化学保护”。
1928 年
1928 年,被后人称为美国阴极保护之父的库恩在新奥尔良一条长输天然气管线上安装了第一台阴极保护整流器,由此开创了管道阴极保护的实际应用。他通过试验发现,保护电位为-0.85v (相对于饱和的 Cu/CuSO 4 参比电极)足以防止任何类型的腐蚀。同年,库恩在美国田家标准局华盛顿防腐蚀大会上报告了这一重要的阴极保护判据。
现代阴极保护技术一般都仍然遵从这一判据。库恩的报告作为一项独立进行的研究工作而致力于讨论由于形成电化学电池而产生的腐蚀,其中包括对一种阴极保护方法的描述,即用整流器产生保护电流实现阴极保护以防止腐蚀。 此外,库恩还写道:“这种方法 , 是专门地仅仅用于阻止土壤腐蚀,而且也用于通过电子排流消除由下有轨电车杂散电流引起的管道电解腐蚀”,他的试验得出结果,为了把管道电位降低到不再产生腐蚀穿孔,平均保护电流密度10 ~ 20mA/m2 就够了。
1970 年
1970 年德国煤气与供水工程师协会为纪念库恩在阴极保护技术发展中做出的卓越贡献,在德国阴极保护专业协会资助下特别颁授了铸有库恩头像和著名的 -850mV 字样的金质纪念章。
20 世纪 30-50 年代
在20世纪30-50年代期间,比利时、前苏联、英国、德国等欧洲国家也先后对埋地管线采用了阴极保护技术。近些年来,国际上关于阴极保护的进展主要在技术发展和工程应用方面,阴极保护设备、材料和配套装置等日臻完善,检测、监控技术和管理系统更加先进,应用领域不断扩大,相应地各国先后制定了一系列阴极保护规范和标准。
3 海洋构筑物知多少
海洋构筑物指海洋环境使用的结构物体,做支撑、运输、动力等作用,往往由金属结构、涂层(包覆层)或者混凝土等组成。具体来讲,有钻井、采油平台,海底管道,港口设施,钢板、钢管桩,舰船及其附属结构,跨海大桥等。它们处于海洋环境,受到海洋环境的腐蚀,可以采取阴极保护加以防护。但其不同之处在于,所采用的金属材料、连接方式、材料表面状况不同,其中阴极保护技术也有所不同。
海上钻井和采油平台由导管架和上部组块构成,平台导管架主体由平台钢构成,如 DH36,处于潮差区、海水和海泥中。潮差区由重防腐涂层防护,海水和海泥中结构均采用裸钢加阴极保护。
随着深海油气资源的开发,水下分离器、储油舱等结构陆续使用,也需要阴极保护。
海底管道通常都有涂覆层和配重层,有单层保温管、双层管;其功能主要是油气输送管道以及电力管道。
舰船及其附属结构包括舰船,螺旋桨、舵、螺旋桨支架,通海吸水箱、浮箱通水口助推器等水下部分;各种船舱有压载舱、淡水舱、燃油舱,海水管路(冷凝器与热交换器)和船舭。
港口设施包括钢板、钢管桩墙、船闸等。

跨海大桥成为近年来我国发展最快的海上设施,处于海水海泥区的桥墩往往需要采用阴极保护。
从海洋构筑物采用的金属材料来分,主要有钢铁,包括低合金钢,中高强钢和不锈钢,也有黄铜白铜、钛及钛合金和铝及铝合金等有色金属:按照应用对象分为管线钢、平台钢、船体钢等:按照材料形状分为板、管、螺纹、复杂结构等。
根据海洋构筑物所处环境,有潮差区,海水全浸区和海泥区:对于深海设施,深海环境的特殊性也对阴极保护提出特殊要求:对于舰船,温度、流速及砂石均对阴极保护产生影响:也有混凝土环境。
海洋构筑物的阴极保护首先涉及环境腐蚀性,材料的特殊性,以及不同环境阴极保护准则。对于长久设施,阴极保护的维护、修复及监 / 检测也是不容忽视的。
4 海洋环境与海洋腐蚀的那些事儿
随着人类对海洋资源的利用逐步走向深入,海洋开发的规模也不断扩大,但是由于海洋环境是一个腐蚀性很强的复杂的灾害环境,各种材料在海洋环境中极易发生劣化破坏,据统计数据表明世界各国每年因腐蚀造成的直接经济损失约占其国民生产总值的 2% ~ 4%,而海洋腐蚀的损失约占总腐蚀的 1/3。尽管如此,如果防护工作做得好,其中25%~40%的损失可以得到有效避免。
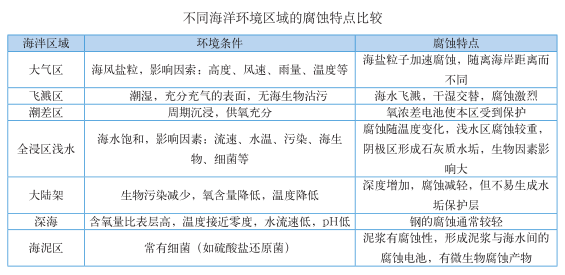
海洋腐蚀环境一般分为海洋大气区、浪花飞溅区、潮差区、海水全浸区和海泥区五个腐蚀区带。
深海环境特点解读
五个区带
通常来说,从腐蚀的角度,可将海洋环境分为五个不同区带:海洋大气区、浪花飞溅区、海洋潮差区、海水全浸区及海底泥土区。
海洋大气区
海洋大气区指海面飞溅区以上的大气区和沿岸大气区。海洋大气区的特点是空气湿度大、含盐量多。暴露在海洋大气区的金属表面常沉积细小海盐颗粒。由于海盐的吸湿性(尤其是氯化钙和氯化镁),易于在金属表面形成液膜。在季节或昼夜变化气温达到露点时尤为明显。同时,尘埃、微生物(霉菌和真菌)在金属表面的沉积,会增强环境的腐蚀性。因此,海洋大气对金属结构的腐蚀程度要比内陆大气严重得多。海洋的风浪条件、距离海面的高度和深入内陆的距离都会影响到海洋大气的腐蚀性。风浪大时,大气中水分多含盐量高,腐蚀性增加。距离海平面 7 ~ 8 米处腐蚀性最强,在此之上越高腐蚀性越弱。随着深入内陆的距离增加,腐蚀性迅速减弱。

降雨量和一定时期内的雨量分布也影响金属在海洋大气中的腐蚀速率。频繁的降雨会冲刷掉金属表面(迎风面)沉积的盐分和吸附的尘埃,使腐蚀减轻。一般背风面的腐蚀比迎风面严重。
温度升高使海洋大气腐蚀加剧。因此同一地区的季节变化会影响腐蚀速率。不同海域由于温度及其他环境因素的差异,海洋大气的腐蚀性差异较大,一般热带腐蚀性最强,温带次之,两极区最弱。
浪花飞溅区
飞溅区指平均高潮线以上海浪飞溅润湿的区段。在飞溅区,海洋构筑物表面几乎连续不断地被充分而又不断更新的海水所润湿。由于波浪和飞溅,海水与空气充分接触,海水含氧量达到最大程度。由于海浪飞溅,对金属表面的冲击和频繁的干湿交替,使氧扩散到金属表面的薄液膜达到了最大可能的速度。另外,在风浪作用下海水的冲击作用也会加剧飞溅区海洋构筑物防腐保护层的破坏。因此,海洋构筑物在海水飞溅区的腐蚀都有一个腐蚀峰值,防腐涂料层在这个区带比其他区带更易脱落。另外,没有海生物沾污也是飞溅区的一个重要特点。
不同海区飞溅带腐蚀程度主要决定于风浪条件和温度。飞溅区金属表面的温度更接近于气温。在风浪大的热带海域海洋构筑物在飞溅区的腐蚀速率最快。
潮差区
海水从平均高潮位到平均低潮位之间的区域称为潮差区。潮差的大小因地区而异。同飞溅区一样,潮差区的金属表面也与充分的海水接触,至少每天有一段时间是如此。但潮差区又与飞溅区不同,潮差区氧的扩散不及飞溅区那么快。飞溅区金属表面温度主要受气温控制,接近于气温。而潮差区金属表面的温度既受气温也受海水温度影响,通常更接近或等于表层海水的温度。飞溅区无海生物附着,而潮汐区海生物会栖居在金属表面上,使金属得到一定程度的局部保护。但是,在冬季有流冰的海域,潮差区的海洋构筑物也会受到冰块的磨蚀。
海水全浸区
在平均低潮线以下直至海底的区域称为海水全浸区,根据海水深度不同,可分为浅海水区和深海水区,二者并无确切的深度界限,一般所说的浅海水区大多指 100 ~ 200m 以内的海水。由于各种海洋环境因素,如温度、含氧量、盐度、pH 随海水深度变化而变化,因此海水深度必然影响到全浸区金属的腐蚀行为。其中,盐度、pH 随海水深度变化幅度不大,不会对腐蚀产生明显的影响。对腐蚀影响较大的是温度和含氧量。同时海水深度还影响海生物活性及碳酸盐水垢的沉淀,这也将对腐蚀产生影响。
海水全浸区的海洋构筑物,其腐蚀受溶解氧、流速、盐度、温度、污染和海生物等因素的影响。海洋构筑物在海水中的腐蚀反应受到氧的还原反应所控制,所以溶解氧对钢铁腐蚀起着主导作用。海面下 20m 之内为表层海水,表层海水中溶解氧近于饱和,它是全浸条件下腐蚀较重的区域。随着水深的增加,海水中氧含量有所减少,水温随水深而下降,腐蚀性变弱。深海中,由于温度低,压力大,pH 较低,海水中 CaC0 3 低于饱和度,因此,对深海结构物进行阴极保护时不易形成保护性水垢,牺牲阳极消耗比表层要大。
海泥区
海泥区是指海水全浸区以下部分,主要由海底沉积物构成,与陆地土壤不同,海泥区含盐度高,电阻率低,腐蚀性较强。由于海泥区 Cl一 含量高且供氧不足,一般钝性金属(不锈钢、铝合金)的钝化膜是不稳定的。
无论是与陆地土壤相比,还是与全浸区相比,海泥区的氧含量都相当低,因此钢在海泥区的腐蚀速率通常比在全浸区慢。但是,在海底沉积物层里往往都含有细菌等微生物,主要是厌氧的硫酸盐还原菌,它会在缺氧条件下生长繁殖。而且海水的静压力会提高细菌的活性。硫酸盐还原菌能吸收阴极反应的氢原子,促进阴极反应,使海洋构筑物加速腐蚀。
5 深海环境对阴极保护的影响
海水中影响钢铁材料极化性能和保护性钙质沉积层的环境因素有以下几个溶解氧、温度、盐度、值、海水流速和压力等,这些环境因素随海水深度变化而变化,温度、溶解氧存在跃层分布,不同海域跃层深度不同。
溶解氧
通常表层海水含氧量为饱和或接近饱和,跃层区出现最小含氧区,深层区含氧量增加。溶解氧是影响长期阴极保护设计的最主要因素。对钢铁材料进行阴极保护时,所需的保护电流密度受到金属表面溶解氧及其扩散速度的影响。 当溶解氧浓度及扩散速度降低时,理论所需的初期阴极保护电流密度会降低。然而,较低的电流密度下,氧的去极化反应变弱,不利于被保护金属表面值的快速升高,得不到高质量的钙质沉积层,不利于保护中期电流密度的降低。曹振宇等的恒流极化试验显示,达到最低保护电位所需的阴极保护电流密度随着溶解氧浓度的降低而减小。
温度
温度在海面下最初 300m 时下降速度很快,再向下到 1000m 温度下降速度减小。低于 2000m 温度几乎恒定在冰点上下几度范围内。不同海域的温度分布趋于均匀,整个大洋的水温差在3℃左右。温度主要通过影响海水的电导率来影响阴极保护设计。同时,温度又会影响溶解氧和钙质沉积层的形成。钙质沉积层的主要成份是碳酸钙和氢氧化镁,而一般认为碳酸钙是降低电流密度的有效成分。随着温度的降低,碳酸钙的溶解度增大,所以深海低温海水中沉积层的形成受阻。有报道称,在 1000m 的温度为 5℃的海水中,碳酸钙的溶解度会增加 500%。Lin 等研究了不同温度下钙质沉积层的形成过程,结果表明,虽然初始电流密度随温度的升高而升高,但是达到稳定后的电流密度却相反,高温下形成的沉积层的保护效果优于低温下的沉积层,同时进行的温度循环试验表明,高温下形成的沉积层在降低温度后出现溶解情况,伴随着保护电流密度的上升而由低温转为高温时,又有新的沉积层形成,电流密度再次下降。

盐度
海水盐度受海域的地理、水文和气象等因素的影响。表层海水盐度一般在32‰~ 37‰之间,深层海水变化范围较小,一般在 34‰~ 35‰之间。从中国南海实测数据可以看出,深度从 500 米下降到 3000 米时,盐度的变化值仅为0.2‰。盐度主要是通过影响海水电导率而影响阴极保护过程,同时随盐度增加,溶解氧含量会降低。然而鉴于深海与浅海之间的盐度差异不大,因此可以忽略盐度对深海阴极保护的影响。

碳酸盐和 pH 值
从 浅 海 到 深 海 环 境 pH 值 介 于7.5 ~ 8.6 之间,同一海区海水值变化很小。所以深海环境下的对阴极保护的影响与浅海相似。在海水中对钢结构进行阴极保护时,钢铁表面通以阴极电流,因此发生氧还原和或析氢反应。因为控制着海水中碳酸盐的平衡,进而影响着钙质沉积层的形成。对金属进行阴极保护时,金属表面的 pH 值升高,促进了反应的进行,使碳酸根离子浓度增加,促进了碳酸钙的形成。表层海水 pH 值略高,碳酸根离子浓度也较高,而且表层海水中的碳酸钙是过饱和的,在此环境下钙质沉积层较容易生成。随着深度增加,碳酸钙逐渐转变为不饱和状态,这样相同阴极保护电流密度下,钙质沉积层的形成就变得困难。
压力
海水静压力与其深度呈直线关系。Brown 等研究了不同压力下,达到不同保护电位所需要的初始保护电流密度。结果表明,所研究的压力范围(0.1 ~ 250MPa) 内,电流密度的影响不大,其它研究进行的试验也有类似的结论,England 等详细研究了 Sargasso深水 450 ~ 600m 静压力对钙质沉积层的影响。结果表明,21d 的保护试验后形成的沉积层较松软,成分以镁元素为主。Tawns 等模拟了深海压力下碳钢在 -1.1V 电位下 3d 的阴极保护试验。研究表明,虽然在 2500m 深水压力下碳钢表面也形成了较厚的钙质沉积层,但是保护能力变弱,压力对阴极保护的影响还体现在高压下的氢脆问题上。因为压力越大,所需要钢的强度越高,氢脆敏感性越显著,因此在深海高压环境下,阴极保护电位的选择要更加保守和慎重。
海水流速
海水流速随地域和深度不同有较大差异。总体上来说,随着深度的增加,海水流速降低。流速会影响阴极保护电流密度需求和钙质沉积层的形成。因为溶解氧在阴极表面的反应属于扩散控制,海水流速增加,扩散层厚度减小,阴极保护所需要的初始电流密度会显著增加。同时,氧的去极化反应加快导致金属海水界面的pH 值增加,由于反应层 pH 值的改变,金属表面钙质沉积层的成核和沉积过程就会受到影响。曹振宇等采用恒电流法研究了静态和海水流速为 8cm/s 条件下的碳钢的阴极保护过程,结果表明,极化 7d 后达到最低保护电位的最小电流密度分别为100mA/m 2 和 200mA/m 2 。李成杰等研究了不同海水流速下保护电位对沉积层形成的影响,表明在较大的海水流速下,保护电位越负,越有利于致密沉积层的形成。同时,由于附着力差和不稳定的沉积层被冲刷剥离,一定范围内的海水流速条件下形成的沉积层保护性更好。Fischer 等的研究表明,一旦良好的沉积层形成,海水流速在一定范围内不再影响保护电流密度。Finegan等研究发现,天然海水中,形成保护效果最好的沉积层的最佳海水流速为 5cm/s。海洋环境因素随着海域和深度的不同,变化情况复杂,这些因素综合作用于阴极保护和钙质沉积层的形成过程。其中,溶解氧、温度、碳酸盐及压力是影响深海阴极保护及钙质沉积层形成的主要因素。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414





