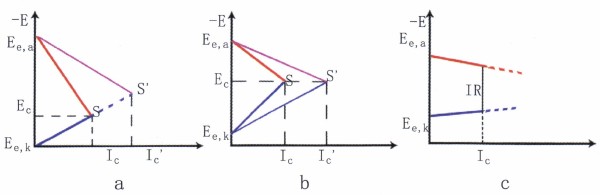
图9工作控制情况下的腐蚀极化图
② 阳极控制的腐蚀过程。如图9a所示,这类腐蚀,阳极极化曲线很陡,阳极反应阻力大,控制着腐蚀速度。如溶液中能形成稳定钝态的金属和合金的腐蚀就是阳极控制腐蚀过程的典型例子。破坏钝态的各种因素均促进腐蚀的阳极反应,从而导致腐蚀显著增大。③混合控制的腐蚀过程。如图9b所示,如果体系的欧姆电阻可以忽略,而阴极极化和阳极极化的程度相差不大,腐蚀受阴、阳极混合控制。例如铝和不锈钢在不完全钝化的状态下的腐蚀属此类。
④欧姆电阻控制的腐蚀。如图9c所示,当通过腐蚀电流表Ic时,相应体系中产生的欧姆助降为IcR,R为系统的总电阻,实质上就等于溶液的电阻。例如地下管线或土壤中金属结构的腐蚀以处于高电阻率的溶液中的金属构件,当它们在溶液相中相距较远时发生的腐蚀都属腐蚀过程。
揭示腐蚀过程中的控制步骤,并在其中设置障碍,进—步增大极化,是控制腐蚀的有效途径。
(2)解释腐蚀现象。
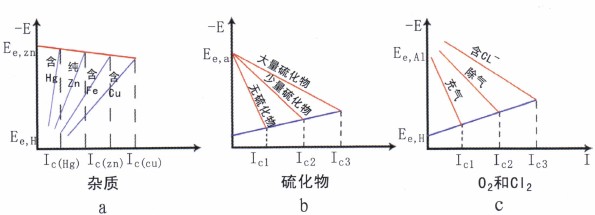
图10不同因素对腐蚀的影响
仅举几例,如图10所示。锌在稀硫酸中的腐蚀见图10a。在锌上析氢过电位高,反应阻力大,属于阴极控制腐蚀。如Cu作为杂质在锌中存在,由于Cu上氢过电位比Zn上的要低,使析H2反应容易,从而增|大了Zn的腐蚀。而Hg上氢过电位要比Zn上的高,所以Hg在Zn中存在,使氢的析出更困难,从而降低了锌的腐蚀即:IC(Hg)< IC (Zn)< IC (Cu)
硫化物对碳钢在酸溶液中的腐蚀,见图10c,酸中硫化氢的存在会促进碳钢的阳极反应,降低阳极极化,从而加速碳钢的腐蚀,即:Ic1<Ic2<IC3
氧和C1-对碳钢在稀硫酸中的腐蚀性能的影响和不锈钢类似。由于铝在充气的稀硫酸中能产生钝化现象,腐蚀速度较小,当溶液中去气后,铝的钝化程度显著变差,阳极极化率变小,腐蚀也增大。当溶液中含活性Cl-时,钝态被破坏,腐蚀大大加剧。
(3)确定阴极保护的可行性,选取保护参数。
由图11可知,该腐蚀是阴极控制腐蚀过程,由此进—步增大阴极极化,容易获得有效的腐蚀控制,故采用阴极保护技术合理、可行。
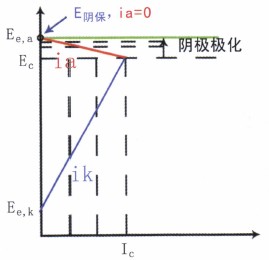
图11 阴极保护的可行性
所谓阴极保护,不管是用牺牲阳极还是外加电流法来实现,其实质就是将被保护设备变成“阴极”,使之阴极极化以达到控制腐蚀的目的。由于阴极电流的通过,被保护设备的电位从腐蚀电位EC开始负移,腐蚀阳极反应的电流ia随之减小,腐蚀减小。当电位移到阳极反应的起始电位Ee,a时,ia=0,腐蚀停止。阴极保护效率达100%。理论上这就是最小阴极保护电位E阴保
实际工程中实施阴极保护时,并不单纯追求100%的保护,还必须考虑:
在E阴保下,是否发生副反应(如H的析出)对设备及其上的涂层有损伤。
在E阴保下是否电能消耗过大,不经济。
总之,要综合分析,并在有较好的保护度下选取合理的保护参数为好。
另外,在研究缓蚀剂等方面也都会用到腐蚀极化图。
由上可见,腐蚀极化图在腐蚀及其控制的研究中是重要的工具,其用途广泛。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。
-
标签: 腐蚀金属极化作用
相关文章
无相关信息

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414
点击排行
PPT新闻
“海洋金属”——钛合金在舰船的
点击数:8135
腐蚀与“海上丝绸之路”
点击数:6475





