为便于准确理解极化作用,经常利用电位E-电流强度I或电流密度i图来描述。如图5所示。
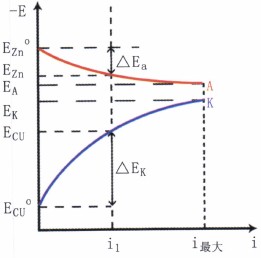
图5极化曲线
图中ECu°和EZn°分别为铜电极和锌电极的开路电位。随着电流密度的增加,阳极电位沿曲线EZn° A向正方向移动,而阴极电位沿曲线ECu°K向负方向移动。把表示电极电位与极化电流密度之间的关系曲线称为极化曲线。图5中EZn° A为阳极极化曲线;而ECu° K为阴极极化曲线。ΔEa和ΔEk分别是在电流密度为i1时的阳极极化值和阴极极化值。
从极化曲线的形状得知,电极极化的大小可判断电极反应的难易程度。若极化曲线较陡,表明极化值较大,反应的阻力大,过程较难进行;若极化曲线较平坦,则表明极化值较小,阻力也小,反应容易进行。
极化产生的原因和类型
极化现象产生的实质在于电子的迁移速度比电极反应及其相关的步骤完成的速度快。进行阳极反应时,金属离子转入溶液的速度落后于电于从阳极流到外电路的速度,这就使阳极上积累起过剩的正电荷,导致阳极电位向正方向移动;在阴极反应中,接受电子的物质来不及与流入阴极的电子相结合,这就使电子在阴极上积累,导致阴极的电位向负方向移动。
任何一个电极反应的进行,都要经过—系列互相连续的步骤,其中阻力最大的、进行最困难的、决定整个电极过程速度的最慢步骤称为控制步骤,电极的极化主要是电极反应过种中控制步骤所受阻力的反映。
极化主要分为两类:电化学极化和浓度极化,其极化曲线的形状如图6所示。
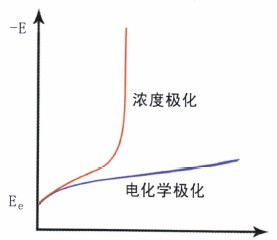
图6有极化时电极过程的极化曲线
电化学极化:如果电极反应所需的活化能较高,因而使有电荷转移的电化学过程速度变得最慢,成了整个电极过程的控制步骤,由此导致的极化称为电化学极化又称活化极化。浓度极化:如果反应物从溶液相中向电极表面运动或产物自电极表面向溶液相内部运动的液相传质步骤很慢以至于成为整个电极反应过程的控制步骤,与此相应的极化称为浓度极化,对于腐蚀来讲,其中的扩散过程最为重要。
腐蚀金属电极及其极化行为
腐蚀体系与腐蚀电位
金属发生腐蚀时,在金属/溶液界面上至少有两个不同的电极过程同时在进行,如图7所示。一个是金属电极反应,另一个溶液中去极化剂在金属表面进行的电极反应。当体系稳定时:
一个是按金属电极过程的阳极反应方向:
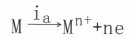 (主a为阳极电流密度)
(主a为阳极电流密度)一个是按去极化剂电极过程的阴极反应方向
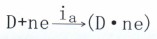 (主k为阴极电流密度)
(主k为阴极电流密度)并以相等的反应速度在进行,即ia=ik+ic
ic为腐蚀电流密度。
此时,由于这两个电极过程的平衡电位Ee,M和Ee,D不相等,它们彼此互相极化,都将偏离各自的平衡电位而相向极化到一个共同的非平衡电位Ec,称之为腐蚀电位。其数值是在这两个反应的平衡电位之间,所以也称为混合电位,即: Ee,M<EC<Ee,D
可见,腐蚀体系是一个共轭体系,是非衡体系所建立起来的稳定电位称之为腐蚀电位。腐蚀过程中的阴、阳极反应为相互耦合的共轭反应,其中的阳极反应是金属材料的溶解,结果导致金属的腐蚀破坏。
腐蚀极化图及其应用
研究金属腐蚀问题时,经常利用图解法。
将阴极和阳极极化曲线绘制在同一个电位—电流坐标图上,再稍加简化得出的图称腐蚀极化图亦称伊 文思极化图,如图8a所示。
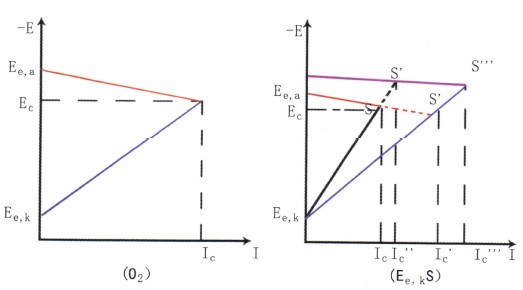
图8阴极控制的腐蚀过程
极化图的应用主要有以下几点。(1)判定腐蚀过程的主要控制因素
①阴极控制的腐蚀过程。如图8b所示,这类腐蚀阴极极化曲线很陡,阳极极化曲线平坦,腐蚀电位EC,接近阳极的起始电位Ee,a,由于是阴极反应困难而控制腐蚀,使任何促进阴极反应的因素,都会使腐蚀显著增大。
碳钢在海水中的腐蚀属于此类情况。流动能促进O2去极化剂的还原反应,故阴极极化曲线Ee,kS′比Ee,kS平坦,从而导致腐蚀速度明显加大(Ic′>Ic),所以流动海水中的腐蚀要比静态中的严重得多。
若在溶液中加入硫化物,因为S2-不但使阳极反应受到催化,而且还使溶液中Fe2+浓度大大降低:导致阳极反应的起始电位更负,使整个阳极极化曲线负移,这也促进腐蚀电流显著加大(Ic′′′> Ic′′)。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。
-
标签: 腐蚀金属极化作用
相关文章
无相关信息

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414
点击排行
PPT新闻
“海洋金属”——钛合金在舰船的
点击数:8135
腐蚀与“海上丝绸之路”
点击数:6475





