生物腐蚀(MIC)是指由微生物或其代谢产物引起或加速的金属或其他材料的腐蚀过程,是一种普遍存在的严重腐蚀形式,广泛发生在石油、天然气、化工、海洋和水处理等领域, 可对设备和环境造成重大损失和危害 [1-5]。MIC 可导致巨大的经济损失,约占全部腐蚀损失 的 20%。因此,MIC 的检测与控制是工业腐蚀科学面临的核心难题。
在水环境中的异质材料表面可以很快形成生物膜细菌聚集体。胞外聚合物(EPS)和微 生物细胞组成的生物膜可以为微生物提供有利的生存环境,抵御外部恶劣环境的干扰。而且, 生物膜内部相对隔绝的环境有利于微生物的代谢活动,从而改变生物膜内的局部微环境,影 响腐蚀机理 [6-8]。此外,生物膜内菌体体系复杂,常存在多种微生物,如硫酸盐还原菌(SRB)、 铁氧化菌(IOB)、锰氧化菌(MOB)、硫酸盐氧化菌(SOB)、酸生成菌(IPB)等,微生物 之间的协同共生也会改变生物膜内的环境参数,进而加速腐蚀过程 [9,10]。鉴于 MIC 过程的 复杂性,开发 MIC 的检测与控制技术是工业腐蚀科学面临的核心难题。
近年来,虽然研究人员对 MIC 机理进行了大量研究,但由于 MIC 系统包含多种微生物、 受多因素影响,其腐蚀机制尚未完全阐明。针对 MIC 过程的危害性和不确定性,采用可靠 的检测技术对其进行检测显得尤为重要 [11,12]。近年来,许多新技术应用于 MIC 检测,如电 化学技术、显微技术、生物分析技术等。这些技术可以检测腐蚀电化学行为、直接观察样品 变化、分析微生物种类等,为研究 MIC 过程提供重要信息。但是,各类技术手段也存在自 身的局限性,如检测范围小、分辨率有限、需要外界扰动等。因此,需要多种技术的联合应 用才能对复杂的 MIC 系统进行全面的表征。
此外,预测和模拟 MIC 的现象和机制,是有效诊断和防治 MIC 的重要手段,也是腐蚀 科学和工程的热点和难点问题。为了预测和模拟 MIC,许多学者提出了不同类型的模型, 从不同的角度和层次描述和解释了 MIC 的影响因素和过程,为 MIC 的研究和应用提供了有 价值的信息和建议 [13,14]。然而,由于 MIC 的复杂性和多样性,没有一个模型能够完全解释 和预测 MIC 的现象,不同类型的模型各有优缺点和适用范围,需要根据不同的目的和条件 来选择合适的模型,或者结合多种模型来提高 MIC 的诊断和防治的效果。
论文对 MIC 的各种检测技术和已有的预测模型进行系统综述,旨在总结现有 MIC 检测 手段的优劣势,分析各类 MIC 预测模型的优势与不足,为选择 MIC 检测手段和预测模型提 供指导。论文第一部分主要归纳了各类 MIC 检测技术,包括电化学技术、显微技术、辐射 技术,生物分析技术和生物传感技术,分析了各技术的工作原理、优点和局限性。论文第二 部分归纳总结了目前主要的 MIC 预测模型,并简要分析了各类模型的优势与不足,并提出 了 MIC 预测模型的发展方向。本综述有助于工业界和学术界更好地认识当前 MIC 检测技术 和预测模型的研究状况,为开发 MIC 的检测与控制技术提供参考。
MIC 的检测方法
1.1 电化学检测法
电化学检测法是通过测量样品的电化学反应来监测和表征金属腐蚀的过程和机理。常用 的电化学方法包括开路电位法、电化学噪声法、线性极化电阻法、动态极化法和电化学阻抗 谱法等。开路电位法的原理是测量金属样品与参比电极之间的稳态电位差,来反映样品在腐 蚀介质中的电化学行为。电化学噪声法通过检测电位和电流的随机扰动,可以判断腐蚀类型是均匀腐蚀还是局部腐蚀。线性极化电阻法给样品施加很小的电位扰动,测量对应电流变化, 由此监测瞬时腐蚀速率。动态极化法在稳态条件下施加较大的电位扰动,考察整个腐蚀反应 过程。电化学阻抗谱法通过施加交变电位,测量响应电流,获得电化学反应机理信息 [15-20]。
此外,丝束电极,又称微电极阵列,是由规则排列的电极丝组成的复合电极。微电极既 能作为大面积电极使用,给出平均信号,又能作为独立探头,测试局部参数,揭示材料表面 腐蚀过程的不均匀性。因此,丝束电极技术在 MIC 研究中广泛应用。本研究团队利用丝束 电极监 SRB 生长周期中铜的整体和局部电化学过程,随着浸泡时间增加,在 SRB 指数生长 期,最大电流密度值 imax 从 0.21 μA cm-2 增加到 0.87 μA cm-2,在稳定期稳定在 0.70 μA cm-2, 然后在衰亡期下降到 0.17 μA cm-2。结果表明,imax 与 SRB 的代谢过程相关。此外,SRB 生 长过程中,阳极位置随浸泡时间变化 [21]。
图 1 基于丝束电极测试 SRB 引起的腐蚀状态 [21]。
电化学检测法的优势在于操作简便、可以实现连续监测,已广泛应用于评价金属材料电 化学行为、判断腐蚀类型与位置、动态监测腐蚀速率以及考究腐蚀机理。但是电化学方法也 存在一些局限性,如部分方法需要施加外部扰动,可能影响稳态过程;数据分析和结果解释 复杂,对局部腐蚀的监测效果较差,重复性存在一定问题 [22-24]。
1.2 生物分析法
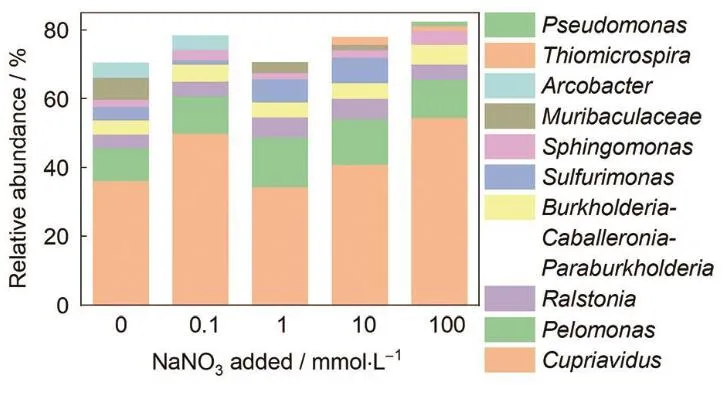
MIC 的特点是微生物群落与金属材料之间的复杂相互作用,准确分析微生物群落的组 成对于理解 MIC 的发生机制至关重要。微生物群落不仅在种类上多种多样,而且在不同的 环境条件下展现出不同的生态功能,即通过特定的代谢途径影响金属材料的腐蚀过程 [25-27]。因此,需要对每个特定环境的微生物群落进行详细分析,以便为 MIC 控制提供针对性的策 略。生物分析法是通过分析样品中微生物的种类、数量和代谢活性来表征 MIC 过程。这类 方法主要包括基因组学分析和代谢组学分析。基因组学分析如 PCR 和基因测序,可以识别 样品中的微生物类型,定量分析不同微生物的相对丰度,为判断 MIC 相关微生物提供依据。代谢组学通过色谱-质谱等技术分析样品中的化学成分,可以揭示微生物群落的代谢通路和活性 [28-31]。本研究团队采用高通量测序法分析了天然海水中硝酸盐添加对 EH40 钢试样表 面腐蚀产物内微生物群落结构的差异。研究发现,在所有海水体系中,EH40 钢表面微生物 群落丰度最高的属为 Cupriavidus,其次是 Pelomonas,这两个属的细菌可进行有氧呼吸。在 未添加硝酸盐的海水中,试样表面微生物群落结构中的硝酸盐还原菌属主要是 Ralstonia 和 Sulfurimonas。添加 0.1 和 1 mM 硝酸盐后,硝酸盐还原菌的优势菌属不变。当添加量为 10 mM 硝酸盐时,除了 Ralstonia 和 Sulfurimonas 外,优势菌属中还出现了 Thiomicrospira 属。进一 步增加添加量至 100 mM 硝酸盐时,硝酸盐还原菌属主要是 Ralstonia、Thiomicrospira 和 Pseudomonas。硝酸盐的添加不仅导致了硝酸盐还原菌属的变化,还影响其丰度 [32]。
图 2 EH40 钢在添加不同浓度硝酸盐的海水中浸泡 12 周后表面微生物群落在属分类水平上 的比较 [32]。
生物分析法可以研究 MIC 过程中微生物群落的遗传多样性和功能特性,从而理解微生 物与金属材料相互作用的复杂性。DNA 测序技术可以识别和量化难以培养的微生物种群, 而宏基因组学则提供了群落中所有基因的全面视图,揭示了微生物群落的代谢潜力和生态功 能。此外,代谢组学技术的应用,通过分析微生物群落的代谢产物,进一步补充了对微生物 活动状态的理解,为评估微生物腐蚀的生物化学机制提供了直接的代谢证据。但是也存在一 些局限性,如需要优化核酸提取和化学成分分析的样品前处理方法,数据处理和解释复杂, 需要专业知识,设备和试剂耗材成本高 [33,34]。
1.3 辐射检测法
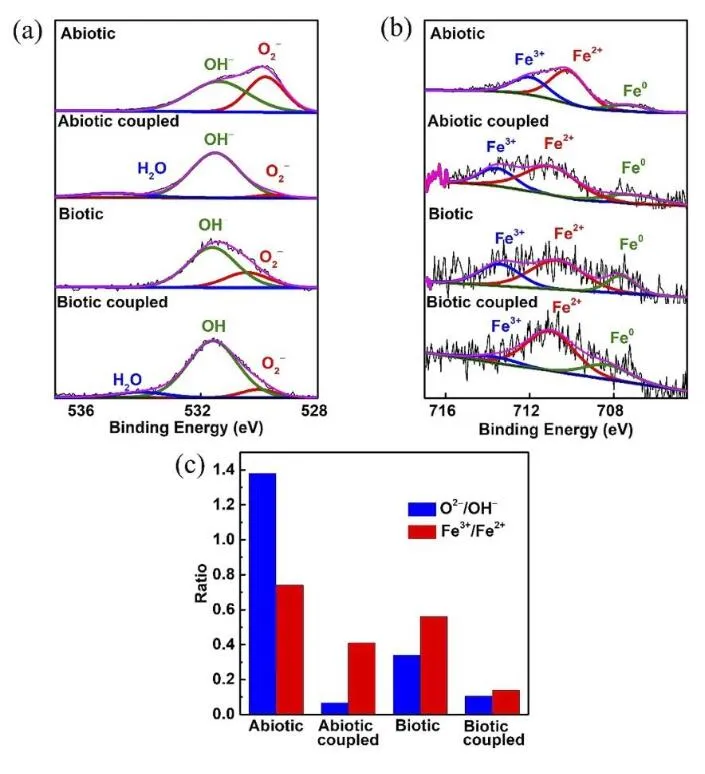
辐射检测技术通过利用 X 射线、紫外线等电磁辐射的吸收、衍射、荧光等效应来分析 样品的化学组成和结构。常用技术包括 X 射线衍射(XRD)、X 射线光电子能谱(XPS)、 能量色散谱(EDS)、拉曼光谱和紫外可见光谱分析(UV-vis)。XRD 可用于评估样品的晶 体结构和化学组成,揭示不同环境下的相变和成分信息,为腐蚀机理和速率提供证据。XPS 可分析样品表面薄层的化学状态及相对组成,评价微生物诱导的表面化学变化。EDS 可用 于比较基本元素组成,识别腐蚀沉积物,结合电子显微镜评估微生物学影响。拉曼光谱和UV-vis 可用于表征无机腐蚀产物和有机物细胞外聚合物的组成 [35-38]。刘宏芳研究团队[39] 在研究 SRB 对富集人工海水中 2205 不锈钢和 X52 碳钢之间电化学腐蚀的研究中,采用 XPS 技术研究了去除生物膜后 2205 钝化层。研究表明,在无菌和 SRB 培养基中,2205 不锈钢 和 X52 碳钢耦合后,表面 O2- /OH-和 Fe3+/Fe2+的比率均有所下降。O2-和 Fe3+含量的减少可能 是由于 Fe(III)氧化物的减少造成。
图 3 去除生物膜后 2205 不锈钢表面钝化层的 O 1s、Fe 2p XPS 谱图、O2- /OH- 和 Fe3+/Fe2+ 的 相应比率[39]。
辐射检测法可以对 MIC 过程中腐蚀产物和生物膜的化学成分进行表征,揭示 MIC 的化 学过程。它们的优点是原理简单,可以快速扫描样品化学信息 [40-42]。但也存在一些局限性。如,如 XRD 成本低但分辨率有限,XPS 可评估成分但空间覆盖有限,EDS 可提供微观信息 但需要复杂数据分析。综合运用这些技术可全面评估微生物腐蚀过程中的样品化学变化。
1.4 显微技术
显微技术的共同原理是通过各种显微仪器直接观察样品的形貌、组织结构、微生物分布 等信息,从而直接观察样品表面变化、生物膜形成及微生物分布情况,对 MIC 过程进行表 征。常用的显微镜技术包括扫描电子显微镜、环境扫描电子显微镜、原子力显微镜和共聚焦 扫描激光显微镜。扫描电子显微镜可快速获得高分辨率的金属基体微观形态图像,直接观察识别微生物活性对腐蚀的影响,但可能会对脆弱的生物样本完整性造成一定损伤。原子力显 微镜是一种灵敏的表面形貌和力学性质定量分析技术,可精确评估异质性生物膜对金属基体 的粘附力大小和腐蚀缺陷尺寸,但其取样和分析范围较小。光学显微镜操作简便快速,可用 于现场直接评估腐蚀表面情况,但分辨率较低,获得的信息不够明确直接。共聚焦扫描激光 显微镜可非破坏性地获得生物膜三维结构和腐蚀微观形貌的深度信息,但需要复杂的样本制 备过程和较高的操作技术 [43-49]。
显微镜技术是微生物腐蚀研究中最常用的表征手段之一。但这类技术也存在一些内在的 局限:首先,显微技术的观察范围有限,仅能提供金属样品局部区域的信息,难以反映整体 腐蚀态势。其次,部分显微技术需要对样本进行复杂的前处理或制备,这可能会对脆弱的生 物样品完整性产生一定的破坏或影响。再者,一些高分辨率的显微技术操作较为复杂,需要 专业的实验人员进行。最后,部分显微系统需要工作在真空条件下,仪器和维护成本也非常 昂贵 [47,50]。
1.5 生物传感法
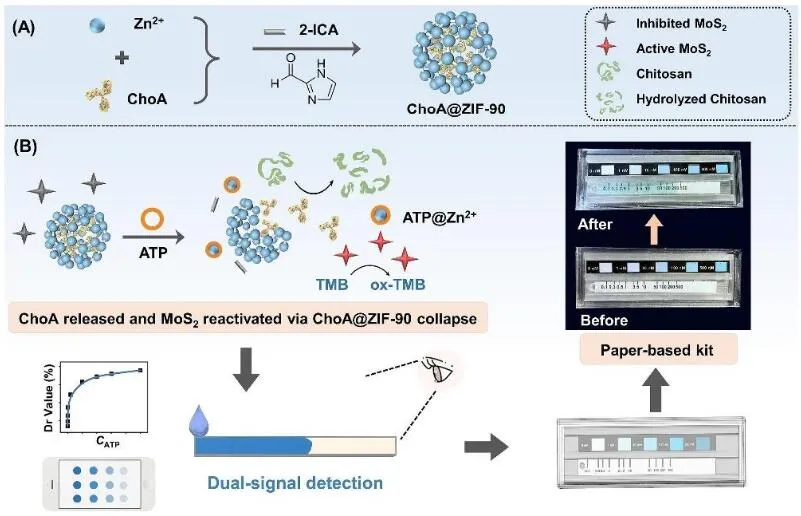
生物传感器是一门由化学、物理学、生物学、材料学等交叉形成的一门学科,是介于信 息学和生物技术之间新的研究热点,具有特异性高,灵敏度高,分析速度快,准确度高,成 本低廉等优点,在食品检测、生态环境科学、医药科学等领域发挥了不容忽视的作用。本研 究团队针对微生物腐蚀检测的难题,开发了一系列针对微生物体系的生物传感方法。首先, 从微生物特异性识别角度出发,针对不同应用场景开发了针对腐蚀微生物的快速传感方法, 揭示了其对腐蚀微生物细胞结构、代谢活性和遗传序列的识别模式和作用机制,实现了典型 腐蚀微生物的快速检测 [51-54]。此外,针对材料表面生物膜内腐蚀微生物的代谢活性难以测 定的难题,开发了适用于生物膜体系的腐蚀微生物活性的生物传感方法。具体内容包括:开 发了高柔韧性全固态离子选择性微探针,采用热力学驱动的电位测试模式,通过引入石墨烯 固态转换层,实现了对活性分子识别过程的界面离子/电子快速转换,摆脱了内充液对电极 基底尺寸和韧性的束缚;开发了基于 MOF 靶向裂解及酶释放的便携式活性试纸条,建立了 靶标分子浓度与体系颜色/扩散性的密切关联,实现了生物膜内靶标分子的可视化测定 [55-58]。
图 4 基于 MOFs 调节水凝胶黏度和纳米酶活性的 ATP 检测试纸条的构建原理图 [55]。
生物传感技术作为一种先进的分析工具,在微生物活动和环境参数的原位监测方面展现 出显著的效能,能够精确捕捉生物膜内微生物代谢活动和腐蚀过程的动态变化。生物传感技 术能够提供较高的空间分辨率,这对于理解微生物群落内部结构和功能分布至关重要。尽管 目前可以用于生物膜微环境检测的生物传感器仍然较少,需要针对不同应用场景开发特定的 传感器,该技术实现过程较为复杂,需要对构建和测试过程不断优化。但凭借其高特异性、 高灵敏度、快速分析、高准确度以及低成本等优势,生物传感技术的研究需求日益增长。
综合而言,电化学技术在实时监测和材料失效表征方面具有优势,但无法测试生物膜内 的微环境状态,且对局部腐蚀的检测能力有限;显微技术能够提供直观的形貌信息,辐射技 术在化学成分分析方面具有高信息量,但这两类方法受限于观察范围和可能对样本造成损 伤,不便于开展实时观测;生物分析技术能够深入到微生物层面,但需要专业的设备和分析 人员,不便于开展现场分析;生物传感技术在快速检测和成本效益方面具有显著优势,但可 能需要针对特定应用进行开发。在选择 MIC 检测手段时,需要根据具体的研究目的、条件 和成本效益比进行综合考虑,有时需要多种技术的联合应用来全面评估 MIC 现象。
2. MIC 预测模型
按照模型的特点和方法进行分类和排序,目前已报道的 MIC 预测模型可以分为三种类 型:基于风险评估的模型、基于传质过程控制的模型和基于电化学腐蚀机理的综合模型 [14,59,60]。
2.1 基于风险评估的模型
Maxwell 等[61]提出了一个基于四个因素(硫化物存在、氧气侵入、管道清理频率和老化 程度)来评估 SRB 致腐蚀率的模型。该定性模型用一个四维的矩阵来表示这些因素的组合, 每个单元格对应一个腐蚀等级。该模型的优点是能够预测 MIC 的可能性,缺点是不能准确 地估计腐蚀进展。2012 年,Bernt 等[62]提出用数学公式分三步来计算 MIC 的风险指数(RI) 和最大腐蚀坑生成速率。第一步结合 qPCR 技术监测 SRB,硫酸盐还原古菌(SRA)和甲烷生 成菌(MET)的数量,并利用每个菌种的体积活性计算 MIC 风险因子。第二步计算基于上述 微生物的最大腐蚀坑生成速率。最后,根据上述两项指标评估 MIC 风险和采取缓释措施。研究表明,在细菌混合菌落中,腐蚀速率增加。在此基础上,该团队又提出通过 RT-qPCR 技术区分微生物的总数量和活性数量,可以更灵敏地评估 MIC 风险。与仅用 qPCR 技术相 比,该模型可以更早期预测管线 MIC [63]。
此外,微生物诱导腐蚀的点蚀形成和生长过程具有随机特性,因此可以采用动态概率模 型,如马尔可夫网络,泊松回归,佩特里网和贝叶斯网络等方法来预测 MIC 的发生 [64]。在 很长一段时间,基于概率学的模型被用于模拟点蚀的随机生成和生长,但这些模型均没有考 虑微生物对腐蚀速率和故障概率的影响。2020 年,Khan 等[65]提出了一种集成贝叶斯网络马尔可夫方法的预测模型,特别关注了操作参数和 SRB 对微生物诱导腐蚀速率的影响,以 及微生物诱导腐蚀速率对长期曝露管道故障可能性的影响,用于预测微生物诱导内部腐蚀速 率、故障概率以及未来腐蚀坑洞深度分布,并评估其对近海系统结构完整性的影响。微生物 诱导腐蚀的影响因素采用贝叶斯网络表示,以捕捉其动态性、非线性依赖性和相互依赖性。根据关键腐蚀坑洞深度状态,采用马尔可夫过程估计近海系统的故障特征和未来微生物诱导 腐蚀坑洞深度分布。
基于风险评估的模型主要用来评估 MIC 的可能性和危害程度,而不是具体的腐蚀速率 的模型,考虑了一些影响 MIC 的因素,如微生物的种类、数量、活性、环境条件等,但没 有涉及电化学和传质过程。这类模型的优点是可以快速地对 MIC 的风险进行评估,为腐蚀 管理和防护提供参考。它们的缺点是不能提供具体的腐蚀速率和机理,也不能考虑电化学和 传质过程的影响,因此精度和适用性有限。
2.2 基于传质过程控制的模型
基于对阴极去极化机理的理解,Peng 等[66]提出结合 Monod 方程、硫酸盐的传质方程, 建立预测 MIC 腐蚀速率的数学模型。该模型考虑了 SRB 在金属表面的电化学作用,以及扩 散、反应和质量传递等过程,能够预测腐蚀坑的形成和发展的三个阶段,但是需要很多参数 和假设,且忽略了生物膜的影响。Al-Darbi 等[67,68]也提出了基于阴极去极化机理的数学模型, 考虑了硫酸盐在生物膜内的扩散和消耗,描述了腐蚀速率与 SRB 硫酸盐消耗速率和点深度 变化的依赖性,并提出由于硫酸盐扩散的限制,点蚀坑经初期的快速生长后进入缓慢稳态生 长阶段。
此外,Melchers 和 Wells[69]提出的模型将 MIC 过程分为瞬态和准稳态两阶段建模。第一 阶段利用 Fick 扩散方程描述营养物质的瞬态扩散。第二阶段近似为准稳态,腐蚀速率与营 养物质浓度和铁锈层扩散速率成正比。Afanasyev 等[70]提出通过活性传质方程描述固体、生 物膜和溶液三相的反应过程,进而建立 MIC 模型,该模型考虑了各相界面之间物质传递和反应,预测了生物矿化对 MIC 的抑制作用。
尽管以上模型从不同的角度构建了基于传质过程控制的模型,但均没有考虑 MIC 过程 中生物膜的动态生长过程。2015 年,Haile 等人提出利用双基质 Monod 方程描述 SRB 的生 长动力学,进而建立 MIC 腐蚀速率模型,该模型考虑了生物量增长、剥落和生物膜的参数, 可以预测 SRB 附着量和腐蚀率的变化趋势 [71]。
2.3 基于电化学腐蚀机理的综合模型
该类模型综合考虑了更多的影响 MIC 的因素和机制,如生物膜的形成和变化、电化学 和传质过程、微生物的种类、数量、活性、代谢产物等,以及环境条件的变化的模型。Gu 等[72]提出了基于 SRB 介导的生物催化阴极硫酸盐还原理论的 MIC 腐蚀模型,该模型提出电 活性 SRB 诱导的腐蚀过程是微生物的外源呼吸过程导致的,利用 Butler-Volmer 方程描述电 荷传递限制,结合营养盐在生物膜内的传质方程,重点考虑了生物膜-金属间的反应动力学 和营养物质在生物膜内的传质过程。在此基础上,又考虑了 APB 产生的腐蚀性有机酸对 MIC 的影响,使模型能够预测更高的腐蚀率 [73]。Xu 等[74]提出了同样基于腐蚀电化学原理 的 SRB 和 APB 的协同作用 MIC 模型,预测了最坏情况下的 MIC 点蚀,通过假设存在侵蚀 性生物膜,并简化了生物膜内硫酸盐的扩散和消耗过程,预测了最坏情况下 MIC 的点蚀速 率。
不同类型的 MIC 预测模型各有优缺点和适用范围,没有一个模型能够完全解释和预测 MIC 的现象。总体而言,基于风险评估的模型主要关注于快速评估 MIC 的风险,其优点在 于能够快速提供 MIC 风险的概览,但无法提供关于腐蚀速率和机理的详细信息。基于传质 过程控制的模型则更进一步,考虑了微生物在金属表面的电化学作用以及与腐蚀过程相关的 传质现象,能够预测腐蚀坑的形成和发展,但需要大量的参数和假设,并且可能忽略了生物 膜的动态变化。基于电化学腐蚀机理的模型综合了生物膜的形成和变化、电化学和传质过程 以及微生物的代谢活动等多种因素,能够提供更为准确和详细的腐蚀预测,但需要大量的参 数输入和解决生物膜内微环境因子的测定问题。因此,需要根据不同的目的和条件来选择合 适的模型,或者结合多种模型来提高 MIC 的诊断和防治的效果。未来的研究方向和建议有 以下几点:(1)发展更多的基于机理的综合模型,以综合考虑所有影响 MIC 的因素和机制, 提供最准确和最完善的腐蚀预测和模拟。(2)改进现有的模型的方法和技术,以提高模型 的求解效率和精度,降低模型的计算量和计算时间,增加模型的稳定性和可靠性。(3)解 决生物膜内微环境因子的测定问题,获取更多的参数和数据,以描述生物膜的特性和变化。微生物腐蚀是发生在生物膜下的腐蚀过程,而由于生物膜内微环境因子测定方法的缺失,导 致无法获得生物膜内微环境的变化规律,仅仅能通过推测估算生物膜内的微环境。因此,为 了更好的解释微生物腐蚀机理,建立可靠的预测模型,必须要解决生物膜内微环境因子的测 定问题
3. 结论
本综述系统阐述了 MIC 的检测技术和预测模型研究进展。MIC 检测技术包括电化学、 生物分析、辐射检测、显微观察和生物传感等,各技术手段优势互补,联合应用可提高 MIC监测效果。MIC 预测模型包括基于风险评估、传质过程和电化学机制的模型,每种模型均 考虑了影响 MIC 的部分因素,但尚无单一模型可完全解释 MIC 机制。未来的 MIC 检测研 究将聚焦于快速现场检测技术的创新,致力于构建符合现场应用要求的检测技术,以实现快 速准确地进行现场监测,并评估 MIC 相关的风险。此外,微生物预测模型的发展趋势将转 向构建基于机理的综合性模型,并通过优化关键参数提升模型的效率和准确度,增强模型的 稳定性和可靠性。事实上,这两方面研究工作的推进均需解决生物膜内微环境因素的测定问 题,以便更为精确的研究生物膜的特征及其演变过程。本综述对已有 MIC 检测和建模研究 进行全面综述,有助于微生物腐蚀科学的发展,也为工业界开发 MIC 的检测与控制技术提 供重要参考。
参考文献
[1] Li C, Wu J J, Zhang D, et al. Effects of Pseudomonas aeruginosa on EH40 steel corrosion in the simulated tidal zone [J]. Water Res., 2023, 232: 119708.
[2] Little B J, Hinks J, Blackwood D J. Microbially influenced corrosion: Towards an interdisciplinary perspective on mechanisms [J]. Int. Biodeterior. Biodegrad., 2020, 154: 105062.
[3] Xu D K, Gu T Y, Lovley D R. Microbially mediated metal corrosion [J]. Nat. Rev. Microbiol., 2023, 21 (11): 705.
[4] Zhang F, Wang H T, He Y J, et al. Case Analysis of Microbial Corrosion in Product Oil Pipeline [J]. J. Chin. Soc. Corros. Prot., 2021, 41 (6): 795. (张斐, 王海涛, 何勇君 等. 成品油输送管道微生物腐蚀案例分析 [J]. 中国腐蚀与防护学报, 2021, 41 (6): 795.)
[5] Ke N, Ni Y Y, He J Q, et al. Research Progress of Metal Corrosion Caused by Extracellular Polymeric Substances of Microorganisms [J]. J. Chin. Soc. Corros. Prot., 2023, 44 (2): 278. (柯楠, 倪莹莹, 何嘉淇 等. 微生物胞外聚合物引起的金属腐蚀的研究进展 [J]. 中国腐蚀与防护学报, 2023, 44 (2): 278. )
[6] Knisz J, Eckert R, Gieg L M, et al. Microbiologically influenced corrosion-more than just microorganisms [J]. FEMS Microbiol. Rev., 2023, 47 (5): fuad041.
[7] Li Z, Huang L Y, Hao W K, et al. Accelerating effect of pyocyanin on microbiologically influenced corrosion of 304 stainless steel by the Pseudomonas aeruginosa biofilm [J]. Bioelectrochemistry, 2022, 146: 108130.
[8] Salgar-Chaparro S J, Lepkova K, Pojtanabuntoeng T, et al. Microbiologically influenced corrosion as a function of environmental conditions: A laboratory study using oilfield multispecies biofilms [J]. Corros. Sci., 2020, 169: 108595.
[9] Ma Y, Zhang Y, Zhang R, et al. Microbiologically influenced corrosion of marine steels within the interaction between steel and biofilms: a brief view [J]. Appl. Microbiol. Biotechnol., 2020, 104 (2): 515.
[10] Li Z X, Lv M Y, Du M. Effect of Combined Potential Polarization on Corrosion of X65 Steel in Seawater Inoculated with Iron Oxiding Bacteria. [J]. J. Chin. Soc. Corros. Prot., 2022, 42 (2): 211. (李振欣, 吕美英, 杜敏. 海水环境中组合电位极化对铁氧化菌腐蚀的影响 [J]. 中国腐蚀与防护学报, 2022, 42 (2): 211.)
[11] Ma Y, Zhang Y M, Zhang R Y, et al. Microbiologically influenced corrosion of marine steels within the interaction between steel and biofilms: a brief view [J]. Appl. Microbiol. Biotechnol., 2020, 104 (2): 515.
[12] Kilbane J. Effect of sample storage conditions on oilfield microbiological samples [C]. NACE CORROSION, 2014: 3788.
[13] Pots B F, Kapusta S D, John R C, et al. Improvements on de Waard-Milliams corrosion prediction and applications to corrosion management [C]. NACE CORROSION, 2002: 02235.
[14] Marciales A, Peralta Y, Haile T, et al. Mechanistic microbiologically influenced corrosion modeling-A review [J]. Corros. Sci., 2019, 146: 99.
[15] Batmanghelich F, Li L, Seo Y. Influence of multispecies biofilms of Pseudomonas aeruginosa and Desulfovibrio vulgaris on the corrosion of cast iron [J]. Corros. Sci., 2017, 121: 94.
[16] Beese P, Venzlaff H, Srinivasan J, et al. Monitoring of anaerobic microbially influenced corrosion via electrochemical frequency modulation [J]. Electrochim. Acta, 2013, 105: 239.
[17] Castaneda H, and Benetton X D. SRB-biofilm influence in active corrosion sites formed at the steel-electrolyte interface when exposed to artificial seawater conditions [J]. Corros. Sci., 2008, 50 (4): 1169.
[18] Debuy S, Pecastaings S, Bergel A, et al. Oxygen-reducing biocathodes designed with pure cultures of microbial strains isolated from seawater biofilms [J]. Int. Biodeterior. Biodegrad., 2015, 103: 16.
[19] Malard E, Kervadec D, Gil O, et al. Interactions between steels and sulphide-producing bacteria-Corrosion of carbon steels and low-alloy steels in natural seawater [J]. Electrochim. Acta, 2008, 54 (1): 8.
[20] Xia D H, Song S Z, Behnamian Y, et al. Review-Electrochemical Noise Applied in Corrosion Science: Theoretical and Mathematical Models towards Quantitative Analysis [J]. J. Electrochem. Soc., 2020, 167 (8).
[21] Chen S, Wang P, Zhang D. Corrosion behavior of copper under biofilm of sulfate-reducing bacteria [J]. Corros. Sci., 2014, 87: 407.
[22] Mansfeld F. The use of electrochemical techniques for the investigation and monitoring of microbiologically influenced corrosion and its inhibition - a review [J]. Mater. Corros., 2003, 54 (7): 489.
[23] Pourbaix M. Applications of electrochemistry in corrosion science and in practice [J]. Corros. Sci., 1974, 14 (1): 25.
[24] Searson P C, and Dawson J L. Analysis of Electrochemical Noise Generated by Corroding Electrodes under Open-Circuit Conditions [J]. J. Electrochem. Soc., 1988, 135 (8): 1908.
[25] Qi Z H, Jiang T, Zhao M J, et al. Research Progress on Coatings of Active Control of Microbiological Contamination for Aircraft Fuel System [J]. J. Chin. Soc. Corros. Prot., 2023, 43(4): 821-827. (戚震辉,江涛,赵茂锦 等. 飞机燃油系统微生物污染主动防治涂层研究进展 [J]. 中国腐蚀与防护学报, 2023, 43(4): 821-827.)
[26] Pei Y Y, Guan F, Dong X C, et al. Effect of Desulfovibrio Bizertensis SY-1 on Corrosive Behavior of Metal Materials Under Cathodic Polarization [J]. J. Chin. Soc. Corros. Prot., 2024, 44(2): 345-354. (裴莹莹,管方,董续成 等. Desulfovibrio Bizertensis SY-1 在阴极极化条件下对 X70 管线钢的腐蚀行为研究 [J]. 中国腐蚀与防 护学报, 2024, 44(2): 345-354.)
[27] Ke N, Ni Y Y, He J Q, et al. Research Progress of Metal Corrosion Caused by Extracellular Polymeric Substances of Microorganisms [J]. J. Chin. Soc. Corros. Prot., 2024, 44(2): 278-294. (柯楠,倪莹莹,何嘉淇 等. 微生物胞外聚合物引起的金属腐蚀的研究进展 [J]. 中国腐蚀与防护学报, 2024, 44(2): 278-294.)
[28] Carvalho M L, Doma J, Sztyler M, et al. The study of marine corrosion of copper alloys in chlorinated condenser cooling circuits: The role of microbiological components [J]. Bioelectrochemistry, 2014, 97: 2.
[29] Liang R X, Aktas D F, Aydin E, et al. Anaerobic Biodegradation of Alternative Fuels and Associated Biocorrosion of Carbon Steel in Marine Environments [J]. Environ. Sci. Technol., 2016, 50 (9): 4844.
[30] Teng F, Guan Y T, Zhu W P. Effect of biofilm on cast iron pipe corrosion in drinking water distribution system: Corrosion scales characterization and microbial community structure investigation [J]. Corros. Sci., 2008, 50 (10): 2816.
[31] Kannan P, Su S S, Mannan M S, et al. A Review of Characterization and Quantification Tools for Microbiologically Influenced Corrosion in the Oil and Gas Industry: Current and Future Trends [J]. Ind. Eng. Chem. Res., 2018, 57 (42): 13895.
[32] Wu J J, Xu M, Wang P, et al. Impact of nitrate addition on EH40 steel corrosion in natural seawater [J]. J. Chin. Soc. Corros. Prot., 2023, 43 (4): 765. (吴佳佳,徐鸣,王鹏 等. 天然海水中硝酸盐的添加对 EH40 钢腐蚀的影响 [J]. 中国腐蚀与防护学报, 2023, 43 (4): 765.)
[33] Eckert R B, and Skovhus T L. Advances in the application of molecular microbiological methods in the oil and gas industry and links to microbiologically influenced corrosion [J]. Int. Biodeterior. Biodegrad., 2018, 126: 169.
[34] Gutarowska B, Celikkol-Aydin S, Bonifay V, et al. Metabolomic and high-throughput sequencing analysis-modern approach for the assessment of biodeterioration of materials from historic buildings [J]. Front. Microbiol., 2015, 6: 979.
[35] Chen S Q, Hou R Z, Zhang X, et al. The study of riboflavin-mediated indirect electron transfer process in corrosion of EH40 steel induced by Methanococcus maripaludis [J]. Corros. Sci., 2023, 225: 111567.
[36] Pu Y A, Chen S G, Man C, et al. Investigation on the stress corrosion cracking behavior and mechanism of 90/10 copper-nickel alloy under the cooperative effect of tensile stress and Desulfovibrio vulgaris [J]. Corros. Sci., 2023, 225: 111617.
[37] Sharma M, Liu H W, Chen S Q, et al. Effect of selected biocides on microbiologically influenced corrosion caused by Desulfovibrio ferrophilus IS5 [J]. Sci. Rep., 2018, 8: 16620.
[38] Wang D, Yang C T, Zheng B R, et al. Microbiologically influenced corrosion of CoCrFeMnNi high entropy alloy by sulfate-reducing bacterium Desulfovibrio vulgaris [J]. Corros. Sci., 2023, 223: 111429.
[39] Wan H H, Zhang T S, Xu Z X, et al. Effect of sulfate reducing bacteria on the galvanic corrosion behavior of X52 carbon steel and 2205 stainless steel bimetallic couple [J]. Corros. Sci., 2023, 212: 110963.
[40] Kagarise C, Vera J R, Eckert R B. The importance of deposit characterization in mitigating UDC and MIC in dead legs [C]. NACE CORROSION, 2017: 9128.
[41] Haruna K, Obot I, Saleh T, Infrared Spectroscopy in Corrosion Research [c]. Corros. Sci., Apple Academic Press(2023): 261
[42] Dwivedi D, Lepková K, Becker T. Carbon steel corrosion: a review of key surface properties and characterization methods [J]. RSC adv., 2017, 7 (8): 4580.
[43] Beech I B. Corrosion of technical materials in the presence of biofilms - current understanding and state-of-the art methods of study [J]. Int. Biodeterior. Biodegrad., 2004, 53 (3): 177.
[44] Cui T Y, Qian H C, Lou Y T, et al. Single-cell level investigation of microbiologically induced degradation of passive film of stainless steel via FIB-SEM/TEM and multi-mode AFM [J]. Corros. Sci., 2022, 206: 110543.
[45] Steele A, Goddard D T, Beech I B. An atomic force microscopy study of the biodeterioration of stainless steel in the presence of bacterial biofilms [J]. Int. Biodeterior. Biodegrad., 1994, 34 (1): 35.
[46] Surman S B, Walker J T, Goddard D T, et al. Comparison of microscope techniques for the examination of biofilms [J]. J. Microbiol. Methods, 1996, 25 (1): 57.
[47] Wei B X, Xu J, Gao L Q, et al. Nanosecond pulsed laser-assisted modified copper surface structure: Enhanced surface microhardness and microbial corrosion resistance [J]. J. Mater. Sci. Technol., 2022, 107: 111.
[48] Gao Q Y, Zeng W G, Wang H, et al. Effect of Fluid Scouring on Sulfate Reducting Bacteria Induced Corrosion of Pipeline Steel [J]. J. Chin. Soc. Corros. Prot., 2023, 43(5): 1087-1093. (高秋英,曾文广,王恒 等. 流体冲刷作用对 SRB 的腐蚀行为影响研究 [J]. 中国腐蚀与防护学报, 2023, 43(5): 1087-1093.)
[49] Xu D K, Xia J, Zhou E Z, et al. Accelerated corrosion of 2205 duplex stainless steel caused by marine aerobic Pseudomonas aeruginosa biofilm [J]. Bioelectrochemistry, 2017, 113: 1.
[50] Yazdi M, Khan F, Abbassi R, et al. A review of risk-based decision-making models for microbiologically influenced corrosion (MIC) in offshore pipelines [J]. Reliab. Eng. Syst. Safe., 2022, 223: 108474.
[51] Zeng Y, Qi P, Chen J, et al. Target aided self-assembly of DNA hyperbranched nanostructures for bacterial 16 S ribosomal DNA gene SERS detection [J]. Sensor. Actuat. Chem., 2023, 396: 134423.
[52] Zeng Y, Qi P, Zhou Y, et al. Multi pathogenic microorganisms determination using DNA composites-encapsulated DNA silver nanocluster/graphene oxide-based system through rolling cycle amplification [J]. Microchim. Acta, 2022, 189 (11): 1.
[53] Zeng Y, Qi P, Wang Y, et al. DNA pom-pom nanostructure as a multifunctional platform for pathogenic bacteria determination and inactivation [J]. Biosens. Bioelectron., 2021, 177: 112982.
[54] Qi P, Wan Y, Zeng Y, et al. Rapid detection methods for sulfate-reducing bacteria in marine environments [J]. J. Chin. Soc. Corros. Prot., 2019, 39 (5): 387. (戚鹏,万逸,曾艳 等. 海洋环境中硫酸盐还原菌的快速测定方法研究 [J]. 中国腐蚀与防护学报, 2019, 39 (5): 387. )
[55] Wang Y, Zhang D, Sun Y, et al. Precise localization and simultaneous bacterial eradication of biofilms based on nanocontainers with successive responsive property toward pH and ATP [J]. ACS Appl. Mater. Interfaces, 2023, 15 (6): 8424.
[56] Wang Y, Zhang D, Zeng Y, et al. Selective ATP Detection via Activation of MoS2-Based Artificial Nanozymes Inhibited by ZIF-90 Nanoparticles [J]. ACS Appl. Nano Mater., 2021, 4 (11): 11545.
[57] Wang Y, Zhang D, Zeng Y, et al. Target-modulated competitive binding and exonuclease I-powered strategy for the simultaneous and rapid detection of biological targets [J]. Biosens. Bioelectron., 2022, 198: 113817.
[58] Wang Y, Qi P, Zhang D, et al. Dual-signal viscosity flow paper sensor for ATP detection based on bio-recognition and nanozyme activity regulation of ZIF-90 [J]. Chem. Eng. J., 2024: 148590.
[59] Beech W B, and Sunner J. Biocorrosion: towards understanding interactions between biofilms and metals [J]. Curr. Opin. Biotechnol., 2004, 15 (3): 181.
[60] Videla H A, and Herrera L K. Microbiologically influenced corrosion: looking to the future [J]. Int. Microbiol., 2005, 8 (3): 169.
[61] Maxwell S, Predicting microbially influenced corrosion (MIC) in seawater injection systems [C]. SPE International Oilfield Corrosion Conference and Exhibition, SPE(2006), 100519-MS
[62] Sørensen K B, Thomsen U S, Juhler S, et al. Cost efficient MIC management system based on molecular microbiological methods [C]. NACE CORROSION, 2012: 1111.
[63] Larsen J, Sørense K B, Juhler S, et al. The application of molecular microbiological methods for early warning of MIC in pipelines [C]. NACE CORROSION, 2013: 2029.
[64] Hong H-P. Application of the stochastic process to pitting corrosion [J]. Corrosion, 1999, 55 (1): 10.
[65] Adumene S, Adedigba S, Khan F, et al. An integrated dynamic failure assessment model for offshore components under microbiologically influenced corrosion [J]. Ocean Eng., 2020, 218: 108082.
[66] Peng C G, Suen S Y, Park J. Modeling of anaerobic corrosion influenced by sulfate‐reducing bacteria [J]. Water Environ. Res., 1994, 66 (5): 707.
[67] von Wolzogen Kühr C, and Van der Vlugt L. The graphitization of cast iron as an electrobiochemical process in anaerobic soil [J]. Water, 1934, 18 (16): 147.
[68] Al‐Darbi M, Agha K, Islam M. Comprehensive modelling of the pitting biocorrosion of steel [J]. Can. J. Chem. Eng., 2005, 83 (5): 872.
[69] Melchers R E, and Wells T. Models for the anaerobic phases of marine immersion corrosion [J]. Corros. Sci., 2006, 48 (7): 1791.
[70] Afanasyev M, van Paassen L, Heimovaara T, A numerical model of controlled bioinduced mineralization in a porous medium to prevent corrosion [C]. EGU General Assembly Conference Abstracts, (2013): EGU2013
[71] Haile T, Teevens P, Zhu Z. Sulphate-reducing bacteria growth kinetics'-based microbiologically influenced corrosion predictive model [J]. J. Pipeline Eng., 2015, 14 (4): 259.
[72] Gu T, Zhao K, Nesic S. A new mechanistic model for MIC based on a biocatalytic cathodic sulfate reduction theory [C]. NACE CORROSION, 2009: 09390.
[73] Gu T. Theoretical modeling of the possibility of acid producing bacteria causing fast pitting biocorrosion [J]. J. Microbiol Biochem. Technol., 2014, 6 (2): 068.
[74] Xu D, Li Y, Gu T. Mechanistic modeling of biocorrosion caused by biofilms of sulfate reducing bacteria and acid producing bacteria [J]. Bioelectrochemistry, 2016, 110: 52.
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414