摘要
基于自行设计组装的盐酸液膜腐蚀模拟装置,采用腐蚀挂片、电阻探针、Tafel极化、电化学阻抗等方法,研究了316L和HR-2不锈钢在浓度分别为1、0.5和0.1 mol/L,温度分别为90、70和60 ℃的盐酸蒸汽环境中的钝化和点蚀行为,并利用金相显微镜、XRD对腐蚀试样和腐蚀产物进行了分析。结果表明:两种不锈钢的腐蚀速率随时间先加快后减慢最后趋于稳定,316L不锈钢的腐蚀速率相对较高;两种不锈钢均能形成稳定钝化区,且维钝电流密度相差不大,HR-2孔蚀电位的钝化区间总体都比316L不锈钢高,说明HR-2不锈
关键词: 不锈钢,液膜环境,模拟装置,电化学测试,钝化与点蚀,表征及分析
盐酸液膜是由盐酸蒸汽冷凝到材料表面形成的液膜,对材料造成的腐蚀比直接由同浓度和温度环境的盐酸溶液腐蚀更快。而且其腐蚀速率与盐酸浓度和材料所处的温度环境有关,形成的液膜稳定性不强,对于电化学实验难度较大。盐酸液膜的腐蚀就相当于盐酸露点腐蚀,引起露点腐蚀的气体一般包括SO2、SO3、HCl、NOx、H2S等,这些酸性混合蒸汽冷凝生成的硫酸、盐酸、氢硫酸等易造成工业设备的严重点腐蚀穿孔。在实际工程生产中,酸性液膜腐蚀主要位于初馏塔、闪蒸塔的顶部、塔顶冷回流时的常压塔顶部、塔顶温度跨初凝区的油气冷凝冷却器及其相关管道。其中腐蚀最严重的是常减压塔顶冷却系统。所以,酸性液膜腐蚀在电力、石油化工等领域造成的破坏备受关注,耐腐蚀材料的研究和防腐措施亟待优化。
王彦亮等[1]采用Tafel极化、阻抗谱及Mott-Schottky技术研究了316L不锈钢在pH值分别为4.7和11的硼酸溶液中的电化学,结果表明均能形成稳定的钝化膜,钝化区间随pH值升高而减小,过钝电位明显降低。周多等[2]讨论了化学清洗对凝汽器316L不锈钢管腐蚀穿孔的影响,化学清洗剂中存在的Cl-会对凝汽器材料腐蚀穿孔。陈宇等[3]研究了316L不锈钢在硼酸溶液中钝化膜的电化学性能,结果表明,316L不锈钢在硼酸溶液中能形成良好的钝化膜,使腐蚀速率降低。杨柳青等[4]的研究表明,316L和HR-2不锈钢在6%的酸性FeCl3溶液中都呈现出良好的耐腐蚀性,在相同的环境和腐蚀时间后,316L不锈钢表面的点腐蚀总是比HR-2不锈钢更严重。316L奥氏体不锈钢常用于制造管道、热交换器等;HR-2奥氏体不锈钢具有一般奥氏体不锈钢所具有的稳定性和抗腐蚀性,在能源及相关领域中得到了广泛应用[5]。对316L不锈钢的耐腐蚀性能的研究[6]表明,腐蚀环境中C1-浓度增大、温度升高或pH值降低能使316L不锈钢的腐蚀加快[7,8,9,10]。C1-在钝化膜表面的吸附是孔蚀形核的必经之路,Cl-能增强电解液的导电性能,促进表面活性点的活化,加速小孔的溶解,降低孔蚀电位[11,12]。然而,有关HR-2不锈钢腐蚀行为的研究报道却较少[13]。
本文采用Tafel极化、电化学阻抗谱 (EIS)、挂片腐蚀、电阻探针和X射线衍射谱等方法,研究盐酸浓度和温度对316L和HR-2不锈钢在盐酸液膜中的电化学行为的影响、点蚀情况及其钝化膜的性质。
1 实验方法
实验装置如图1中,电极从左到右依次为Ag/AgCl参比电极、石墨电极、工作电极以及探针温度计。油浴温度设置在130 ℃,蒸发瓶里配制一定浓度的盐酸溶液,在油浴锅的加热作用下产生HCl气体和水蒸气。两种混合气体在冷凝管的三电极体系表面遇冷后形成液膜或液滴,电极试样通过上方的铜导线与外界电化学工作站相连,将浸湿NaOH溶液的棉花球塞住冷凝管顶部出口,用于尾气吸收,测试所用溶液为1、0.5和0.1 mol/L盐酸溶液,溶液体积为0.4 L。
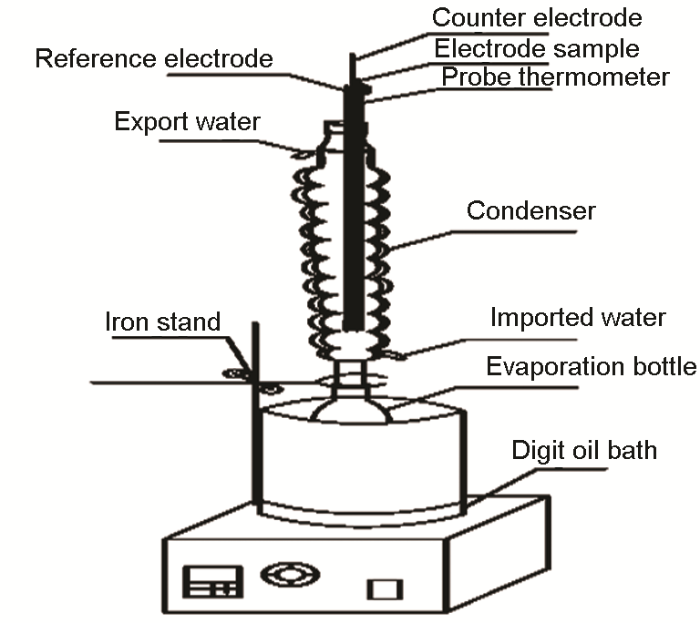
图1 电化学测试实验装置
采用316L 和HR-2奥氏体不锈钢作为实验材料,其化学成分 (质量分数,%) 如表1。
表1 两种不锈钢的化学成分 (mass fraction / %)
实验用金属腐蚀失重挂片,挂片位置为温度90 ℃位置,挂片直径为4 mm、高度为50 mm的带孔柱体试样,用240#,360#,400#,600#,800#,1000#的金相砂纸由粗到细依次打磨后用去离子水、丙酮和酒精清洗干净,然后吹干,在干燥箱内干燥,称重精确到0.1 mg。电化学测试电极的尺寸为Φ4 mm×2 mm,用Cu导线焊接后进行固封,用金相砂纸逐级打磨工作面后用去离子水、无水乙醇和丙酮进行清洗并吹干备用。
电阻探针试样为两种不锈钢 (316L和HR-2不锈钢) 用线切割加工成的Φ0.4 mm×12 mm的线状探针,腐蚀挂片实验前,将两根同种材料加工好的探针用丙酮和乙醇依次冲洗,吹干至室温下测量一头至另一头10 mm位置处的电阻稳定值,并做好记录。将测量的10 mm位置处系上细绳,并与挂片试样一起挂入已加热沸腾的冷凝管90 ℃位置,互不接触,而且底端齐平。待实验结束后,取出探针,用蒸馏水轻轻冲洗后,吹干降至常温后测量电阻值,带入公式计算腐蚀速率,并绘制两种材料电阻探针腐蚀动力学曲线。
本实验设计3个浓度 (1、0.5和0.1 mol/L) 盐酸溶液,在设定条件下将电阻探针试样用细线挂好放入同一高度位置 (T=90 ℃位置),挂片时间为24、48、96和144 h;每种材料每个时间挂片为2片,实验数据求其平均值。完成挂片实验后,腐蚀试样用去离子水清洗干净,放入干燥箱内干燥24 h,称量精确到0.1 mg。用BM-200C金相显微镜、D/max-2500/PCX射线衍射仪 (XRD) 分析表面腐蚀产物和测定腐蚀区域的化学组成。
Tafel极化和电化学阻抗谱 (EIS) 测试在型号为CS350电化学工作站上进行,采用经典三电极体系,316L和HR-2不锈钢试样制成工作电极,石墨电极作为辅助电极,探针温度计测量腐蚀体系中三电极体系末端温度,并且这三个电极连接紧密与探针温度计底部始终在同一水平线上。本文所有电位如无特殊说明,均相对于所用的参比电极而言。Tafel极化实验,扫描范围为相对开路电位-0.1~0.2 V。EIS测试扰动电位为10 mV,频率测试范围为105~10-2 Hz,电压扰动振幅为50 mV,扫描速率范围为105~10-2 Hz。
2 结果与讨论
2.1 两种材料在不同温度和浓度下电化学分析
2.1.1 Tafel极化测试分析
从表2,3,4可以看出,两种材料随着温度的增大自腐蚀电位Ecorr逐渐降低。腐蚀电位的降低是由于C1-在钢体表面上的局部聚集和氯化物被水解,导致局部酸性环境[14],引起腐蚀电位的降低。此外,随着Cl-浓度的增加,316L和HR-2不锈钢的腐蚀电流密度Ip增加,根据Farady第二定律,腐蚀电流密度与腐蚀速率成正比,这表明随着腐蚀速率的温度增加,316L和HR-2不锈钢的腐蚀速率增加。同时,对比发现316L不锈钢的Ip一直大于同浓度下HR-2不锈钢的Ip,表明316L不锈钢腐蚀速率一直大于HR-2不锈钢的腐蚀速率。
表2 316L和HR-2不锈钢在1 mol/L HCl溶液不同温度的Tafel拟合数据
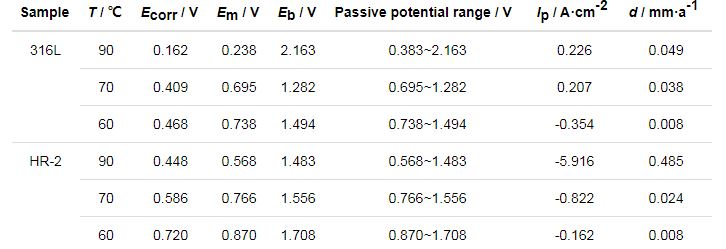
表3 316L和HR-2不锈钢在0.5 mol/L HCl溶液不同温度的Tafel拟合数据
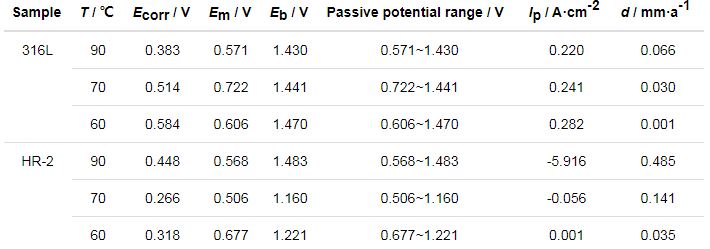
表4 316L和HR-2不锈钢在0.1 mol/L HCl溶液中不同温度Tafel拟合数据
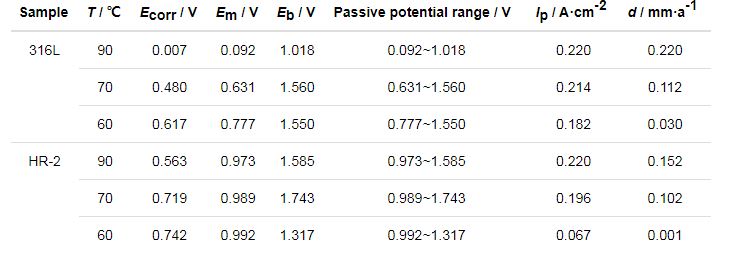
两种不锈钢在3种不同盐酸浓度环境中均能形成稳定钝化区,且电位Em相差不大。随着HCl浓度的增加,钝化间隔通常会增加。如果极化电位超过过电位,腐蚀电流将迅速增加,表明此时钝化膜不稳定并溶解。另外,随着Cl-浓度的增加,电极的点蚀电位Eb降低,金属钝化膜不稳定,容易破坏,材料更容易发生点腐蚀,加速腐蚀速度。HR-2孔蚀电位总体比316L不锈钢高,并且HR-2不锈钢的钝化区间总体也比316L不锈钢高,说明HR-2不锈钢更耐腐蚀。
2.1.2 EIS测试结果
研究[14]表明,容抗弧半径大小既反映了电荷传质阻力的大小,容抗弧越大,表明电荷传质阻力越大,越耐腐蚀,反之表明电荷传质阻力越小;又可反映钝化膜阻抗的大小以及钝化能力的强弱,容抗弧半径越大则钝化膜阻抗越大、钝化能力越强。图2为电化学阻抗谱的等效电路,图3,4,5分别为316L和HR-2不锈钢在HCl浓度为1、0.5和0.1 mol/L,温度为60、70和90 ℃环境的EIS拟合图。
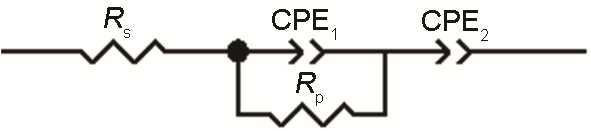
图2 电化学阻抗谱的等效电路图
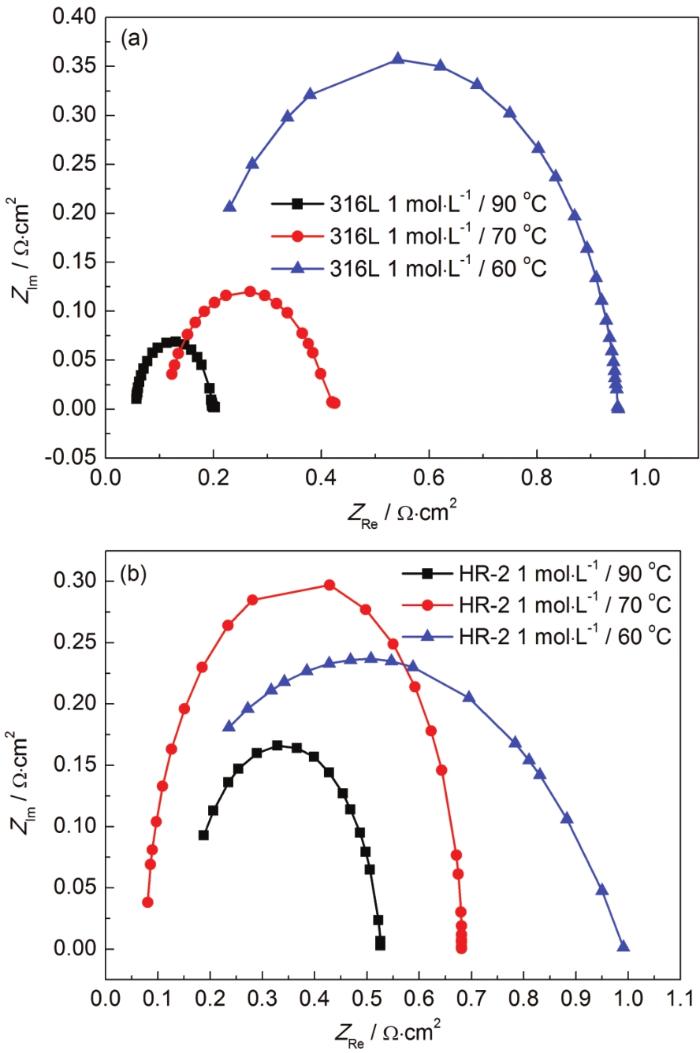
图3 316L和HR-2不锈钢在1 mol/L 90、70和60 ℃ HCl溶液中的电化学阻抗图
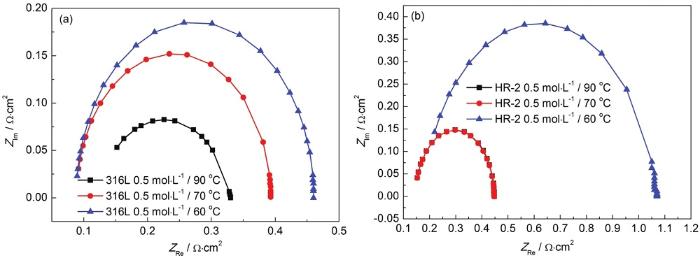
图4 316L和HR-2不锈钢在0.5 mol/L 90、70和60 ℃ HCl溶液中的电化学阻抗图
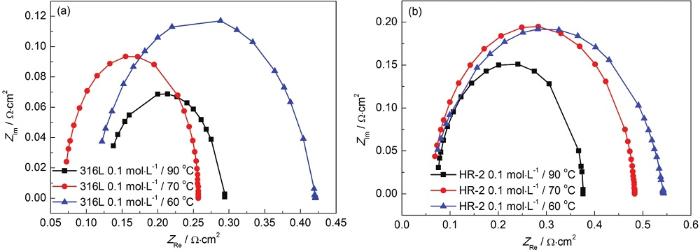
图5 316L和HR-2不锈钢在0.1 mol/L 90、70和60 ℃ HCl溶液中的电化学阻抗图
对于同一种不锈钢,同一浓度下,随着温度的升高,容抗弧越小,溶液电阻Rs逐渐减小,蚀点内溶液极化电阻Rp也变小,代表电容量的CPE-T逐渐增大。所以HR-2不锈钢比316L不锈钢更耐腐蚀,这一点与Tafel极化曲线的结果是一致的。在相同的温度和材料下,随着HCl浓度的增加,C1-浓度继续增加。随着反应的进行,金属表面上的腐蚀产物膜不断增厚,阻碍氧和Cl-的传质过程,然后引起腐蚀过程减速;腐蚀后期,随着腐蚀产物的增多,无法均匀地覆盖金属表面,在其间隙Cl-会发生富集,促进点蚀的产生,从而使腐蚀速率逐渐变快。因此,两种不锈钢在HCl液膜环境中腐蚀速率是先减小后逐渐增大。
2.2 两种材料不同时间下腐蚀特性研究
2.2.1 失重腐蚀速率分析
图6为两种材料在1和0.5 mol/L HCl溶液不同模拟时间后的腐蚀动力学曲线,挂片位置为85~90 ℃区域。由图6可知,两种材料的腐蚀速率在两种浓度环境下腐蚀速率变化趋势相近。24~48 h时腐蚀不断加快,第48 h时速率达到最大;48~96 h时腐蚀逐步减慢;由于腐蚀产物在腐蚀前48 h不太可能形成薄膜,腐蚀性介质可以完全接触钢体,并且腐蚀速率加快。48~96 h腐蚀后,在金属表面形成稳定致密的钝化膜,增强了对钢体的保护作用。阻碍腐蚀性介质的进一步渗透,腐蚀速率减慢。96 h之后腐蚀速率增大,表面钢体生成的钝化膜被液膜中的大量Cl-侵入,破坏了钝化膜,使腐蚀速率加快。由整体腐蚀情况来可看出,HR-2不锈钢整体腐蚀失重较小,腐蚀速率较慢;并且两种钢在1 mol/L HCl溶液环境下腐蚀各阶段的腐蚀速率均高于0.5 mol/L HCl溶液;由于HR-2钢中Cr含量较高,Cr具有抗氧化性能并能促进内锈层中稳定相α-FeOOH的生成[15],使腐蚀锈层与金属结合更紧密,对钢体保护作用更强;所以HR-2比316L钢更耐腐蚀。
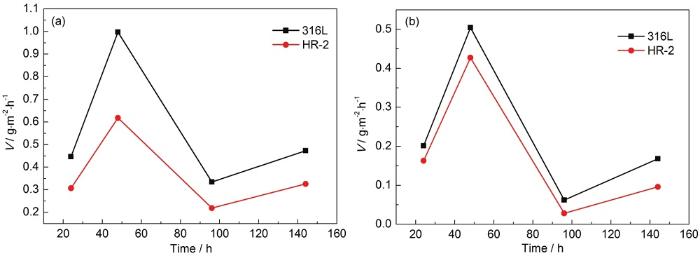
图6 两种材料在1和0.5 mol/L HCl溶液中不同模拟时间后的腐蚀动力学曲线
2.2.2 电阻探针腐蚀速率分析
图7为两种材料电阻探针在1和0.5 mol/L HCl溶液的不同模拟时间后的腐蚀动力学曲线,挂片位置为85~90 ℃区域。两种材料的腐蚀速率在24~48 h腐蚀时不断加快,第48 h时腐蚀速率达到最大;48~96 h时腐蚀逐步减慢。由于腐蚀前48 h腐蚀产物较少,未能成膜,腐蚀介质能充分与钢体接触,腐蚀速率不断加快;腐蚀后期即48~96 h时金属表面形成稳定致密的锈层,对钢体的保护作用加强进而阻碍了腐蚀介质进一步渗入,腐蚀速率减慢。96 h之后腐蚀速率增大,表面钢体生成的钝化膜被液膜中的大量Cl-侵入,破坏了钝化膜,使腐蚀速率加快。这与腐蚀失重数据结果一致。
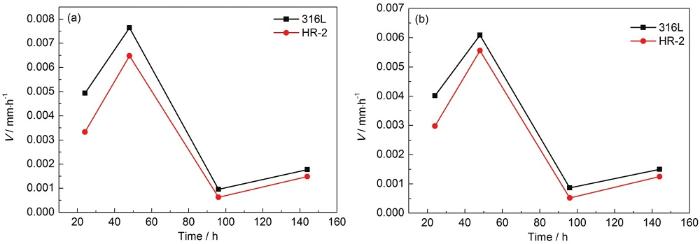
图7 两种材料电阻探针在1和0.5 mol/L HCl溶液中不同模拟时间后的腐蚀动力学曲线
2.2.3 金相微观形貌观测
两种不锈钢在腐蚀24、96和144 h后的表面腐蚀形貌如图8所示,观察可知,在0.5 mol/L HCl溶液中腐蚀24 h,316L和HR-2不锈钢表面出现很少腐蚀坑,而且较分散;腐蚀96 h后,试样表面呈现较多明显腐蚀坑,呈片区状连接,颜色类似暗红色锈层;腐蚀144 h时,两种不锈钢表面出现较多腐蚀层,腐蚀坑更多。对比同一时间下,316L不锈钢都比HR-2不锈钢腐蚀现象更明显,所以HR-2不锈钢比316L不锈钢更耐腐蚀,这与之前电化学、腐蚀挂片和电阻探针结果一致。

图8 两种材料在0.5 mol/L HCl溶液中腐蚀24、96和144 h后的金相形貌
2.2.4 腐蚀产物XRD分析
图9为316L和HR-2不锈钢在0.5 mol/L HCl溶液中腐蚀144 h的XRD图,由图可知,在盐酸液膜环境下,两种管线钢的腐蚀产物包括Fe2O3,Fe3O4,FeOOH,Cr和FeC12·4H2O,对于耐腐蚀性能不同的两种不锈钢,腐蚀产物层基本一样,说明对腐蚀产物的成分没有显著影响。
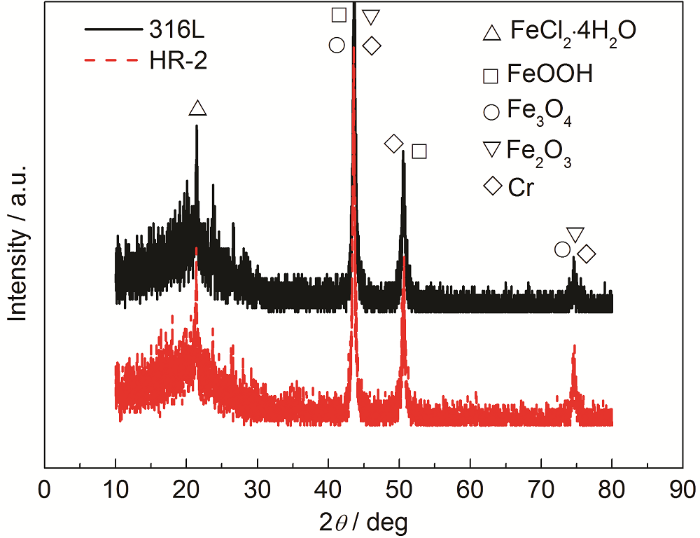
图9 316L和HR-2不锈钢0.5 mol/L HCl溶液中腐蚀144 h的XRD谱
在高浓度Cl-条件下,不锈钢发生阳极溶解[16],电化学反应如下:
Fe2++2H2O=Fe(OH)2+2H+
(1)
Fe(OH)2很容易进一步氧化成FeOOH
Fe(OH)2→FeOOH+H2O+e
(2)
FeOOH脱水后生成Fe2O3和Fe3O4[17]。
由于C1-当量的酸性阴离子,该过程使得不锈钢表面呈弱酸性,继而促进不锈钢表面的活性位点优先腐蚀:
Fe+2H+=Fe2++H2↑
(3)
Fe2++2C1-=FeC12
(4)
另一个是竞争吸附理论[18]。由于O的吸附被C1-的竞争所取代,不锈钢的表面部分地被剥夺氧,然后Cr的氧化大大减少。因此,钢体表面上的钝化膜难以形成或破坏,并且更可能导致不锈钢点蚀。另外,C1-会穿入钢体表面的钝化膜消耗其中的氧,然后直接点蚀。
3 结论
(1) 两种材料在两种HCl浓度环境下,失重腐蚀速率变化趋势相近。腐蚀24~48 h,腐蚀速率不断加快;48 h时腐蚀速率达到最大;48~96 h时腐蚀速率逐步减慢,金属表面形成稳定致密的钝化膜;96 h之后腐蚀速率增大,表面钢体生成的钝化膜被液膜中的大量Cl-侵入,破坏钝化膜,形成了点蚀,使腐蚀速率加快。由整体腐蚀情况可看出,HR-2不锈钢腐蚀失重较小,腐蚀速率较慢。
(2) 在两种不同浓度溶液3种不同温度环境中,316L和HR-2不锈钢均能形成稳定钝化区,且维钝电流密度相差不大,在两种不同浓度下,316L不锈钢具有比HR-2不锈钢更高的自腐蚀电流密度。随着浓度的增加,钝化间隔逐渐缩短,自腐蚀电位发生负移。随着反应的进行,在金属表面的间隙中Cl-发生富集,这促进了点腐蚀的产生,从而腐蚀速率逐渐变快;在相同的浓度环境下,腐蚀温度越高,电容电抗弧越小,电荷传质电阻越小,钝化膜阻抗越小,钝化能力越弱,点蚀电位越低,越严重腐蚀。HR-2不锈钢孔蚀电位总体比316L不锈钢高,并且HR-2不锈钢的钝化区间总体也比316L不锈钢高,钝化膜阻抗较大,说明HR-2不锈钢更耐腐蚀。
(3) 两种钢1 mol/L HCl溶液腐蚀144 h的XRD分析得出,两种不锈钢的腐蚀产物包括Fe2O3,Fe3O4,FeOOH,Cr,FeC12·4H2O,对于耐腐蚀性能不同的两种不锈钢,腐蚀产物层基本相同,C1-竞争性吸附导致不锈钢表面局部缺氧,阻碍不锈钢表面Cr的氧化,从而阻碍富Cr钝化膜的形成,导致不锈钢钝化膜的动态平衡失效,膜的钝化变薄促进了不锈钢中点蚀的发生。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62313558-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





