摘要
以过硫酸铵-亚硫酸氢钠为引发剂,将丙烯酰胺单体接枝到淀粉上制备了淀粉接枝共聚物 (St-g-PAM),可作为一种新型“绿色”缓蚀剂。通过失重实验和电化学测试研究了St-g-PAM对1.0 mol/L HCl溶液中Zn的缓蚀效果。结果表明,St-g-PAM在HCl溶液中对Zn具有较好的缓蚀性,是一种混合抑制型缓蚀剂。缓蚀率随St-g-PAM质量浓度的增加而增大;但当浓度超过50 mg/L时,缓蚀率增加变缓慢。在20~50 ℃下,St-g-PAM在Zn表面的吸附过程与Langmuir吸附模型一致。动电位极化曲线和电化学阻抗测试结果表明,St-g-PAM在HCl溶液中对Zn有较好的缓蚀作用,表现为St-g-PAM存在条件下,Zn腐蚀电流密度减小,电荷转移电阻增大。
关键词: 淀粉接枝共聚物; Zn; 缓蚀剂; 缓蚀机理
Zn是一种重要的有色金属,广泛用于钢铁、汽车、造船、家用电器、电池等工业领域。盐酸溶液常用于Zn表面的酸洗和清洁,当暴露在酸溶液中时,Zn表面极容易受到腐蚀[1]。添加缓蚀剂是一种操作简单、成本低廉、适用范围广的金属缓蚀方法[2]。最常见的金属缓蚀剂是氮、氧或含硫有机化合物[3]。然而,其中一些缓蚀剂对环境危害很大,如硫脲类、亚硝酸盐及磷酸盐等[4],因此开发价廉、易得、高效、环境友好型缓蚀剂受到研究者的关注,是金属缓蚀剂的研究热点和发展方向[5]。与低分子化合物相比,高分子聚合物作为缓蚀剂具有持续时间长、高效环保等优点。聚合物作为Zn的缓蚀剂已有相关报道,如聚乙二醇600 (PEG 600) 和聚山梨酯20 (Tween 20) 复合缓蚀剂[6]、羟乙基纤维素 (HEC)[7]等对Zn具有较好的缓蚀作用。
淀粉是一种廉价、丰富的自然资源,容易通过在主链上引入各种官能团进行化学改性,以满足不同的应用目的[8]。将丙烯酰胺单体接枝到淀粉大分子上,生成丙烯酰胺淀粉接枝共聚物,引入了含N的官能团,使其既具有天然淀粉的性能,还具有合成高分子的优良特性,从而增强了吸附性能,会产生良好的缓蚀作用。付惠等[9]研究表明,淀粉接枝共聚物在1.0 mol/L HCl溶液中对钢具有良好的缓蚀作用,缓蚀率随缓蚀剂浓度增加而增大,且在钢表面的吸附符合Langmuir吸附等温式。李向红等[10]研究了木薯淀粉接枝共聚物 (CSGC)、木薯淀粉 (CS) 和丙烯酰胺 (AA) 在1.0 mol/L HCl溶液中对Al的缓蚀作用,CSGC的缓蚀效果明显优于单独使用CS和AA的缓蚀性能;当CSGC用量为50 mg/L时,缓蚀率达90%以上。淀粉接枝共聚物作为缓蚀剂用于防止金属腐蚀中,可满足缓蚀性能的需要,丰富缓蚀剂的种类。
本文以过硫酸铵-亚硫酸氢钠为引发剂,制备了丙烯酰胺淀粉接枝共聚物,采用失重法和电化学测试方法研究了St-g-PAM在1.0 mol/L HCl溶液中对金属Zn的缓蚀性能。通过改变缓蚀剂浓度和温度探究了St-g-PAM缓蚀性能的影响因素,系统性地计算了吸附热力学和腐蚀动力学参数,以此分析缓蚀剂在Zn表面的吸附行为和缓蚀机理。
1 实验方法
1.1 St-g-PAM的制备
将5 g淀粉和100 mL蒸馏水加入含冷凝管、温度计、搅拌装置的四口烧瓶,通入N2,在80 ℃下糊化30 min。糊化完成后,将体系降温至40 ℃,加入15 g丙烯酰胺,稳定10 min,加入6 mmol/L过硫酸铵-亚硫酸氢钠溶液,搅拌反应3 h。反应完成后,用无水乙醇将产物析出,静置30 min,抽滤,得到白色沉淀;在60 ℃下真空干燥至恒重,得粗产品。将粗产品粉碎、研磨后,用滤纸包裹,放置Soxhlet提取器中,用丙酮回流抽提12 h,以除去均聚物;再用无水乙醇多次洗涤,60 ℃下真空干燥至恒重,得到精制的淀粉接枝共聚物[10]。
1.2 St-g-PAM的结构表征
采用FTS-135红外光谱仪 (FTIR) 对St-g-PAM的结构进行分析测定,用KBr压片法,测量范围为400~4000 cm-1。
1.3 失重法
将锌片剪裁成2 cm×2 cm×0.3 mm大小,用砂纸将500#、800#、1000#锌片打磨至光亮,依次用丙酮、无水乙醇和去离子水洗涤,干燥后分别浸泡在1.0 mol/L含不同质量浓度缓蚀剂的HCl溶液中。恒温2 h后取出锌片,洗涤,干燥至恒重后再次称重。每个Zn试样测定3次,计算平均值以减少误差,腐蚀速率ν和缓蚀效率η根据下式计算:

式中,m1和m2分别为锌片腐蚀前、后的质量,g;S为锌片的表面积,m2;t为腐蚀时间,h;νcorr和νcorr(inh) 分别为未添加和添加缓蚀剂锌片的腐蚀速率,g/(m2·h)。
1.4 电化学方法
采用CHI660D电化学工作站三电极体系进行电化学测试。参比电极为饱和甘汞电极,辅助电极为Pt电极,工作电极为Zn电极。Zn电极的制作过程为:将锌片裁成1.0 cm×1.0 cm大小,分别用500#、1000#、2000#砂纸将锌电极的裸露测试面打磨至光亮,再分别用水和丙酮冲洗。将非工作面用环氧树脂灌封,干燥放置。测试前,将电极放入测试溶液中30 min以达到稳定状态。在20 ℃下测试,极化曲线扫描速率为1 mV/s,极化范围为-250~250 mV (相对于开路电压)。电化学阻抗频率范围为105~10-2 Hz,交流信号幅值为10 mV。
1.5 形貌观察
将2 cm×2 cm×0.3 mm的锌片按失重法进行表面处理后,置于恒温20 ℃的1.0 mol/L HCl溶液中,浸泡2 h后取出。用蒸馏水冲洗、干燥后,分别用S-4800-I型扫描电子显微镜 (SEM) 和Dimension Edge,Bruker型原子力显微镜 (AFM) 对表面进行观察。
2 结果与讨论
2.1 St-g-PAM的结构表征
由图1所示,未接枝淀粉 (见光谱a) 在3430 cm-1处的宽吸收峰是—OH的伸缩振动,2929 cm-1处为饱和C—H伸缩振动吸收峰,1020,1082和1162 cm-1处显示出了淀粉中伯醇、仲醇和醚键3个特征吸收峰,1647 cm-1处的峰值是由于淀粉无定形区的吸水性,934 cm-1附近为葡萄糖环的伸缩振动峰。接枝淀粉 (见光谱b) 光谱中均显示出淀粉的特征峰。此外,3423 cm-1附近出现—OH和—NH2叠加形成的特征峰,1675 cm-1为新增酰胺上C=O的伸缩振动吸收峰,1613 cm-1处为N—H的伸缩振动峰,1100~1300 cm-1为C—N的吸收峰[11]。以上结果表明反应生成了淀粉接枝共聚物。
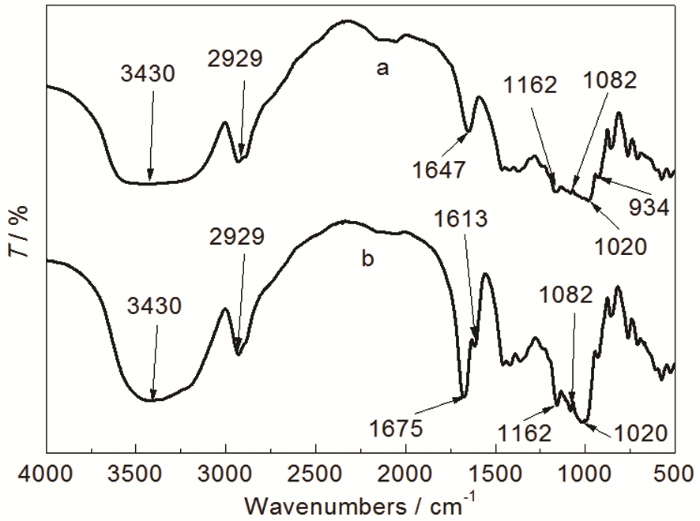
图1 St-g-PAM的红外谱图
2.2 失重法
在20~50 ℃下,对Zn片在含不同质量浓度St-g-PAM的1.0 mol/L HCl溶液中进行失重实验,得到锌片的腐蚀速率值以及缓蚀率与不同质量浓度St-g-PAM关系曲线,如表1和图2所示。可知,添加缓蚀剂能有效减缓Zn的腐蚀。在不同温度下,随着St-g-PAM含量的增加,锌片的缓蚀率不断增加。这是由于St-g-PAM吸附在Zn表面形成了保护层,减小了锌片与腐蚀介质的接触,从而减缓腐蚀速率。当St-g-PAM质量浓度为50 mg/L时,缓蚀率较高。但浓度超过50 mg/L后,缓蚀剂在锌片表面的吸附基本达到饱和状态,之后不会再受浓度的影响。在浓度一定时,随着腐蚀介质温度的升高,吸附在锌片上的St-g-PAM分子会发生脱附,缓蚀率逐渐下降[12]。
表1 不同温度下锌片在不同质量浓度St-g-PAM的1.0 mol/L HCl溶液中的腐蚀速率
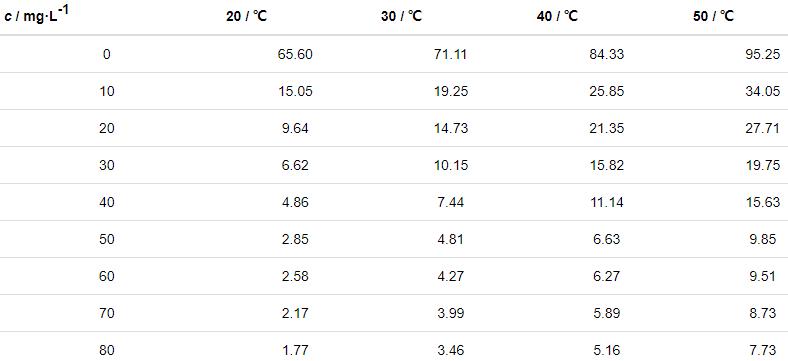
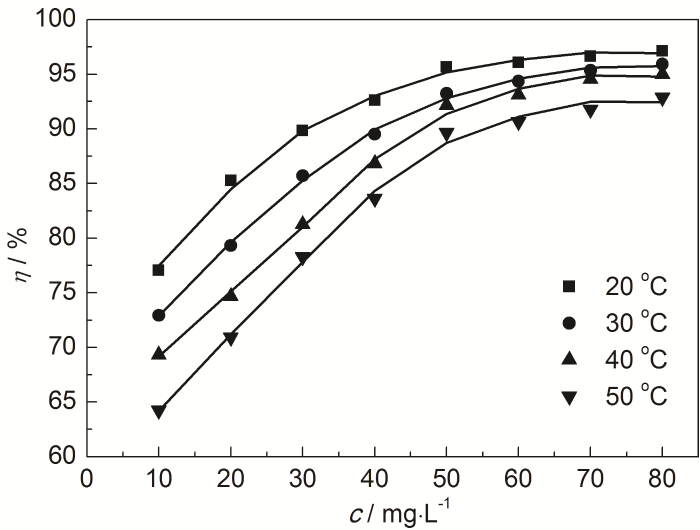
图2 不同温度下缓蚀率与缓蚀剂St-g-PAM质量浓度的关系曲线
2.3 动电位极化曲线
由图3测得的极化曲线可以看出,添加St-g-PAM缓蚀剂后阴阳两极电流密度明显减小,说明缓蚀剂对阴阳两极均产生了抑制作用。通过Tafel直线外推法测定极化曲线参数[13],按下式计算缓蚀率,结果列于表2。
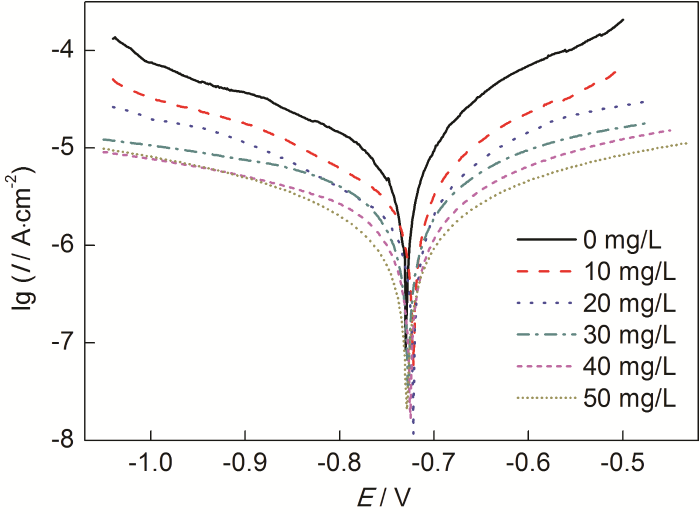
图3 Zn在含不同质量浓度St-g-PAM的1.0 mol/L HCl溶液中的极化曲线
式中,I0corr和Icorr分别为空白溶液和加缓蚀剂后的腐蚀电流密度。
表2 Zn在不同质量浓度St-g-PAM条件下的极化曲线参数
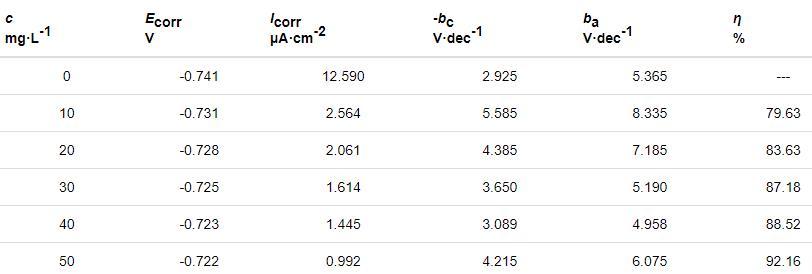
从表2可知,加入St-g-PAM后,腐蚀电位Ecorr略微向正方向移动,但移动值小于85 mV,说明St-g-PAM是混合型抑制剂,缓蚀作用机理为“几何覆盖效应”[14]。Icorr是评价电极体系腐蚀快慢的重要参数[15]。Icorr随St-g-PAM质量浓度的增加而不断下降,说明Zn的腐蚀程度不断降低。当St-g-PAM质量浓度为50 mg/L时,η为92.16%,说明缓蚀剂对Zn在HCl溶液中的腐蚀具有良好的缓蚀作用。加入St-g-PAM后,阴阳极Tafel斜率bc和ba均发生变化,这是因为St-g-PAM吸附覆盖了Zn表面的有效反应面积,使Zn-HCl溶液界面发生改变。此外,通过改变St-g-PAM质量浓度,Tafel曲线的斜率未见规律性的变化,说明缓蚀剂对H的析出和Zn的溶解都没有影响,即缓蚀剂不影响Zn的溶解机制[16]。
2.4 电化学阻抗
由图4测得的Nyquist图可知,加入不同质量浓度的St-g-PAM后,阻抗谱形状相似,说明体系的腐蚀电化学原理未发生改变。阻抗谱呈现单一半圆容抗弧,表明体系中金属表面和缓蚀剂分子之间形成的电荷转移吸附物发生在电极/溶液界面,且电荷转移过程控制腐蚀反应[17],反映出电荷转移电阻Rt和双电层电容Cdl组成的阻容弛豫过程[18]。加入缓蚀剂后,容抗弧的直径显著变大。另外,St-g-PAM分子在电极表面吸附、脱附使电极表面变粗糙,体系产生频率弥散效应,因此容抗弧并不显示完整的半圆[19]。
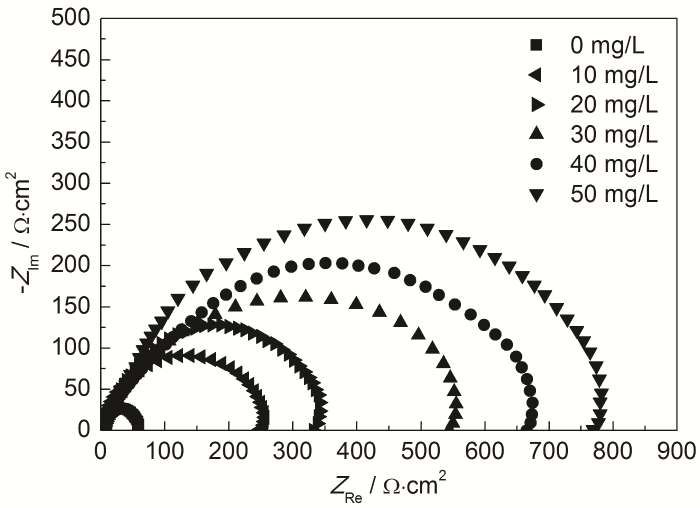
图4 Zn在含不同质量浓度St-g-PAM的1.0 mol/L HCl溶液中的Nyquist图
采用图5所示的等效电路图对数据进行拟合,其中Rs为溶液电阻 (Ω·cm2),Rct为电荷转移电阻,CPE为常相位角元件。CPE由组分Qdl和系数a组成,该系数用来表述不同的物理现象,如表面粗糙度、缓蚀剂吸附、多孔层形成等导致表面不均匀性;当电极表面均匀且呈平面时,a等于1,则电极表面为理想双电层电容。Qdl和Cdl关系式如下[17]:
![]()
式中,fmax表示虚值在Nyqutist图上达到最大值的频率,Hz;Qdl为常相位角元件参数,μΩ-1·sa·cm-2;a为弥散效应系数。各等效电路图的元件参数及η值列于表3。缓蚀效率根据下式计算:
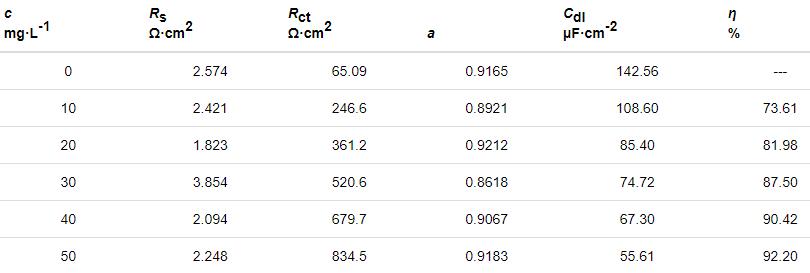
表3 Zn在不同质量浓度St-g-PAM下的阻抗参数
![]()
由表3可见,加入缓蚀剂后,Rt明显增大,而Cdl不断减小,这是由于St-g-PAM取代了原本吸附在Zn表面的水分子,介电常数变小或双电层厚度增加[20]。当St-g-PAM质量浓度为50 mg/L时,η达92.2%,说明St-g-PAM缓蚀剂能有效抑制Zn的腐蚀。缓蚀率随浓度的变化规律与极化曲线测得的结果相同。
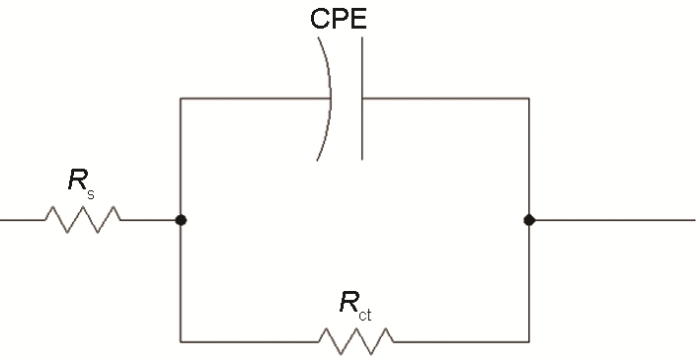
图5 拟合电化学阻抗谱的等效电路图
2.5 吸附等温式
根据失重和电化学实验结果,探究St-g-PAM分子在Zn表面的吸附作用。假设缓蚀剂作用于Zn表面符合Langmuir吸附等温式,按下式进行数据拟合[4]:
![]()
式中,c为缓蚀剂质量浓度;θ为表面覆盖度,近似等于缓蚀率;K为吸附平衡常数L/mg。
对20~50 ℃下失重数据和20 ℃下电化学数据的c/θ-c作图 (图6),得吸附等温线,其参数见表4。
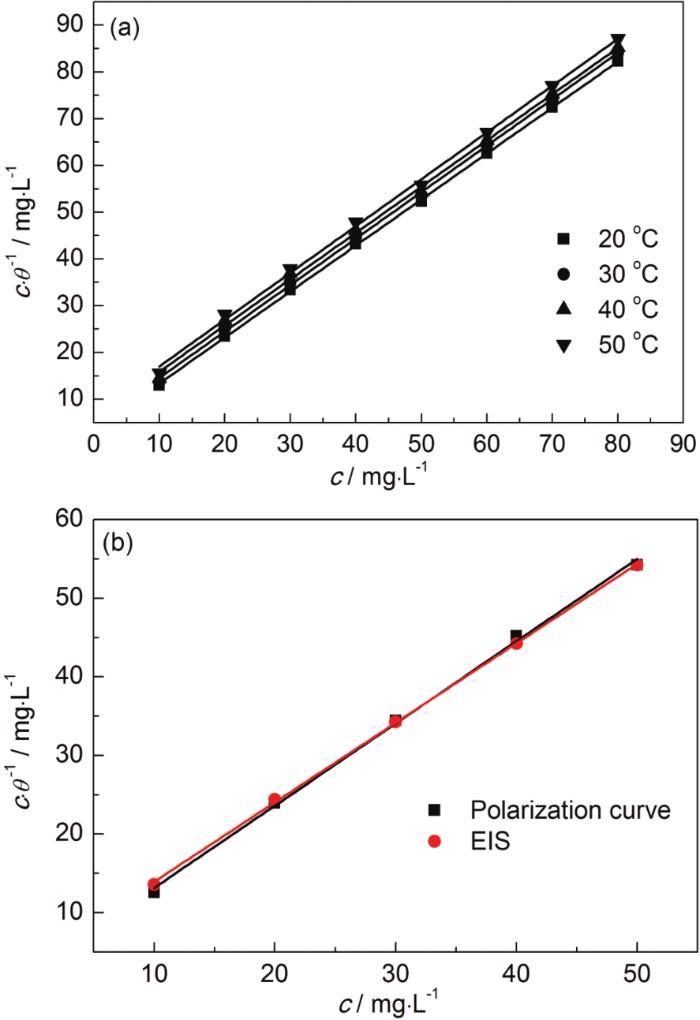
图6 St-g-PAM在Zn表面的Langmuir吸附等温线
表4 c/θ-c直线回归参数表
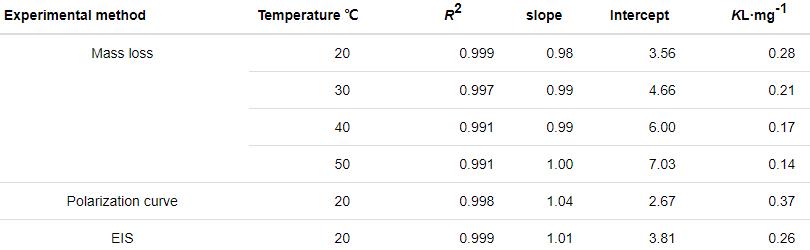
由表4可知,c/θ-c关系曲线的R2和直线斜率均接近1,表明St-g-PAM对锌片的缓蚀作用与Langmuir吸附模型一致。失重实验中吸附平衡常数K随温度的升高而降低,这是由于温度升高,缓蚀体系中分子碰撞加快,Zn表面的腐蚀也显著增加,Zn表面吸附的分子/离子的相互作用力变大,因此St-g-PAM缓蚀剂分子较难吸附在Zn表面[11]。
2.6 吸附热力学
Zn表面吸附的热力学参数,标准吸附焓 (ΔH0) 可依据Van't Hoff方程计算[21]:
![]()
式中,R为标准气体常数;T为热力学温度,K;B为不定积分常数。对lnK-1/T进行直线拟合,见图7,R2为0.9889,说明lnK与1/T之间具有线性关系,根据直线斜率求出ΔH0。
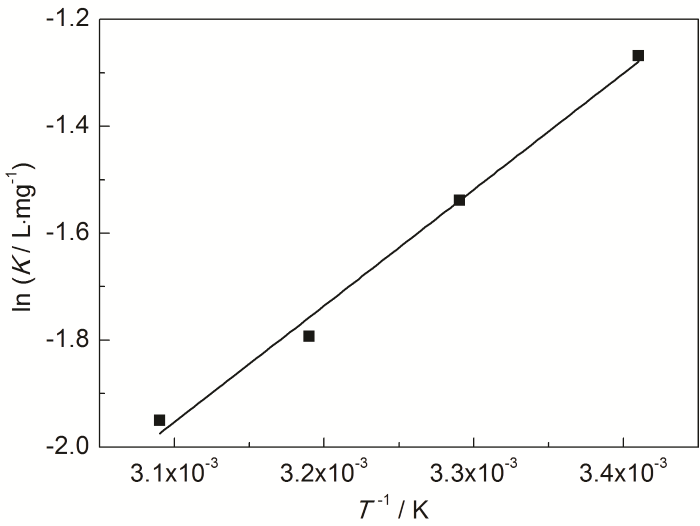
图7 St-g-PAM在Zn表面吸附的lnK-1/T的关系曲线
标准吸附Gibbs自由能ΔG0与K之间存在如下关系式[22]:
![]()
式中,cH2O为溶剂水的质量浓度,近似值为1×106 mg/L;ΔG0为标准吸附Gibbs自由能,kJ/mol。
通过下面的热力学公式求得标准吸附熵ΔS0,吸附热力学参数见表5。
![]()
表5 St-g-PAM在Zn表面的吸附热力学参数
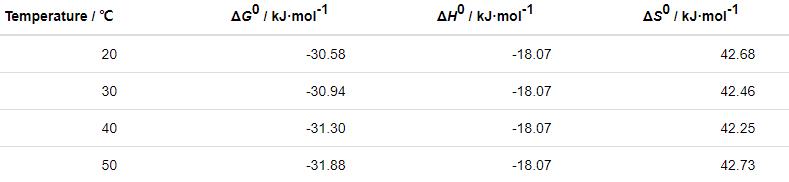
由以上计算可知,ΔH0<0,说明St-g-PAM在Zn表面的吸附过程是放热过程,随温度升高,缓蚀剂分子吸附程度减弱,缓蚀性能降低。ΔG0<0,且在-40~-20 kJ/mol,说明缓蚀剂在Zn表面是由物理-化学作用下自发进行吸附的[12]。ΔS0>0,说明St-g-PAM分子在Zn表面的驱动取代了水分子。由于水分子脱附会引起混乱程度剧增,其远大于St-g-PAM分子吸附在Zn表面引起的混乱程度的减小,因此体系的混乱程度相对增大[23]。
2.7 腐蚀动力学
在293~332 K的温度范围内,探究温度对Zn腐蚀的影响,得到含不同浓度缓蚀剂的活化能、活化焓、活化熵等参数。
活化能与金属腐蚀反应的快慢有关,根据Arrhenius方程[24]:
![]()
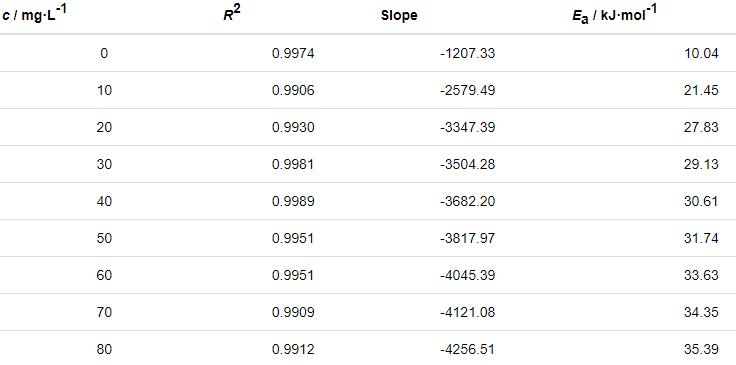
式中,ν为失重实验的腐蚀速率;Ea为表观活化能;A为指前因子。以lnν对1/T作图,见图8。可以看出,lnν与1/T具有良好的线性关系。根据直线的斜率可计算出Ea,如表6。
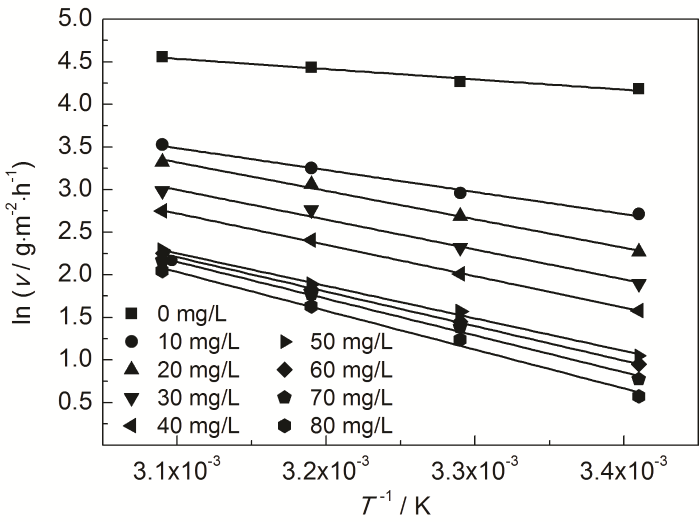
图8 St-g-PAM在Zn表面吸附的lnν与1/T的关系曲线
表6 由lnν-1/T关系曲线拟合得到的腐蚀动力学参数
根据过渡态理论的关系式[25]:
![]()
式中,NA为Avogadro常数 (6.02×1023 mol),h为Plank常数 (6.626×10-34 J·s),ΔH≠是活化焓,ΔS≠是活化熵。作ln (ν/T)-1/T直线,见图9。根据直线斜率和截距求出ΔH≠和ΔS≠,所求得的动力学参数列于表7。
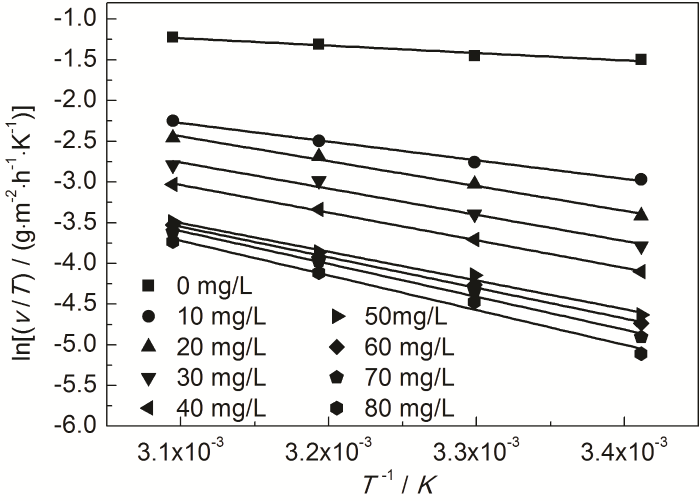
图9 St-g-PAM在Zn表面吸附的 ln (ν/T) 与1/T的关系曲线
表7 由ln (ν/T)-1/T直线拟合得到的腐蚀动力学参数
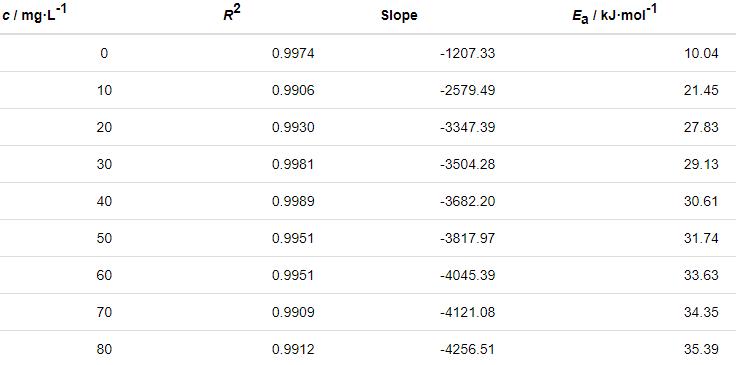
由表6可知,添加St-g-PAM体系的Ea高于空白溶液的,说明随着温度的升高,缓蚀剂的吸附过程减缓,缓蚀作用降低。随着St-g-PAM含量的增加,活化能增加,由于加入缓蚀剂后,缓蚀剂分子覆盖在Zn表面,使Zn发生腐蚀反应的活性位点减少,Zn发生腐蚀反应所需要的能量变高,腐蚀反应变慢[11]。由表7可知,ΔH≠>0,说明锌片溶解是吸热过程。ΔS≠<0,说明速率控制步骤是将反应物转变为活化络合物的缔结过程,而非离解过程,同时表明反应物到活化络合物的无序度降低。加入缓蚀剂后,ΔS≠逐渐变大,说明腐蚀反应越来越难进行[18]。
2.8 表面形貌分析
图10为锌片在20 ℃下1.0 mol/L HCl溶液中浸泡2 h后的SEM和AFM像。如图10a和b所示,锌片在未加缓蚀剂时腐蚀严重,并生成腐蚀产物,表面粗糙,凹凸不平。而在添加缓蚀剂后 (图10c),锌片腐蚀程度明显较轻,表面甚至显示出打磨的痕迹,几乎无“沟壑”;图10d亦表明,Zn腐蚀表面仍然相对平整和均匀。添加缓蚀剂后,表面粗糙度从40.16 nm降到12.41 nm,说明St-g-PAM有效抑制了锌片在盐酸介质中的腐蚀。

图10 Zn在20 ℃下1.0 mol/L HCl溶液中浸泡2 h的SEM和AFM像
2.9 缓蚀机理
根据上述实验与分析,得出淀粉接枝共聚物的缓蚀作用机理为:Zn在腐蚀过程中,会吸附HCl溶液中的Cl-,使Zn表面产生负电荷,而St-g-PAM分子中含较多的N、O原子,易在酸溶液中被H+质子化,因此质子化的St-g-PAM由于静电引力吸附在带负电的Zn表面,形成一层均匀的吸附层[26];St-g-PAM中的N、O原子的孤对电子与Zn的空d轨道形成配位键,产生化学吸附,生成配位化合物,整齐排列到金属表面。由于物理和化学吸附两种作用力共同作用,St-g-PAM在Zn表面产生良好的缓蚀效果。
3 结论
(1) 添加淀粉接枝共聚物St-g-PAM后,Zn在HCl溶液中的腐蚀受到显著抑制。随着St-g-PAM添加量增加,缓蚀率不断增大,而温度升高,缓蚀效果降低。St-g-PAM在锌片的吸附过程与Langmuir吸附模型一致。
(2) St-g-PAM在Zn表面的吸附过程是放热过程,其通过物理和化学方式自发吸附在Zn表面抑制其腐蚀。
(3) 随着St-g-PAM添加量的增加,Zn腐蚀电流密度减小,电荷转移电阻增大,说明St-g-PAM对Zn在HCl溶液中具有良好的缓蚀性能,并且是一种混合抑制型缓蚀剂。
参考文献
[1]Abdallah M, Ahmed S A, Altass H M, et al.
Competent inhibitor for the corrosion of zinc in hydrochloric acid based on 2,6-bis-[1-(2-phenylhydrazono) ethyl] pyridine
[J]. Chem. Eng. Commun., 2019, 206: 137
[本文引用: 1]
[2]Ren T G, Su H S, Liu Y, et al.
Research progress of metal corrosion inhibitors
[J]. Chem. Res., 2018, 29: 331
[本文引用: 1]
任铁钢, 苏慧双, 刘月等.
金属缓蚀剂的研究进展
[J]. 化学研究, 2018, 29: 331
[本文引用: 1]
[3]Shi H, Shi J, Tang J J, et al.
Corrosion inhibition of cetyltrimethyl ammonium bromide for zinc in hydrochloric acid solution
[J]. Clean. World, 2012, 28(10): 22
[本文引用: 1]
史慧, 史静, 唐俊杰等.
十六烷基三甲基溴化铵在盐酸介质中对锌的缓蚀作用
[J]. 清洗世界, 2012, 28(10): 22
[本文引用: 1]
[4]Wang X, Ren S F, Jiang H, et al.
Preparation method and research direction of plant corrosion inhibitors
[J]. Surf. Technol., 2018, 47(3): 196
[本文引用: 2]
王霞, 任帅飞, 蒋欢等.
植物缓蚀剂的制备方法与研究方向
[J]. 表面技术, 2018, 47(3): 196
[本文引用: 2]
[5]Abiola O K, James A O.
The effects of Aloe vera extract on corrosion and kinetics of corrosion process of zinc in HCl solution
[J]. Corros. Sci., 2010, 52: 661
[本文引用: 1]
[6]Liang M, Zhou H B, Huang Q M, et al.
Synergistic effect of polyethylene glycol 600 and polysorbate 20 on corrosion inhibition of zinc anode in alkaline batteries
[J]. J. Appl. Electrochem., 2011, 41: 991
[本文引用: 1]
[7]Deyab M A.
Hydroxyethyl cellulose as efficient organic inhibitor of zinc-carbon battery corrosion in ammonium chloride solution: Electrochemical and surface morphology studies
[J]. J. Power Sources, 2015, 280: 190
[本文引用: 1]
[8]Du Q, Wei H, Li A M, et al.
Evaluation of the starch-based flocculants on flocculation of hairwork wastewater
[J]. Sci. Total Environ., 2017, 601/602: 1628
[本文引用: 1]
[9]Fu H, Li X H, Li Y X, et al.
Corrosion inhibition of cassava starch graft acryl amide copolymer for cold rolled steel in hydrochloric acid
[J]. J. Chin. Soc. Corros. Prot., 2011, 31: 265
[本文引用: 1]
付惠, 李向红, 李云仙等.
木薯淀粉接枝共聚物在盐酸介质中对冷轧钢的缓蚀作用
[J]. 中国腐蚀与防护学报, 2011, 31: 265
[本文引用: 1]
[10]Li X H, Fu H, Li Y X, et al.
Corrosion inhibition of cassava starch graft copolymer for Al in HCl solution
[J]. Corros. Sci. Prot. Technol., 2016, 28: 525
[本文引用: 2]
李向红, 付惠, 李云仙等.
木薯淀粉接枝共聚物在HCl溶液中对Al的缓蚀性能研究
[J]. 腐蚀科学与防护技术, 2016, 28: 525
[本文引用: 2]
[11]Li X H, Deng S D, Lin T, et al.
Cassava starch-sodium allylsulfonate-acryl amide graft copolymer as an effective inhibitor of aluminum corrosion in HCl solution
[J]. J. Taiwan Inst. Chem. Eng., 2018, 86: 252
[本文引用: 3]
[12]Liu J, Zhao D S, Li J J, et al.
Inhibition performance of Gemini surfactant for znic in acid medium
[J]. Corros. Prot., 2016, 37: 983
[本文引用: 2]
刘静, 赵地顺, 李静静等.
酸性溶液中双子表面活性剂对金属锌的缓蚀性能
[J]. 腐蚀与防护, 2016, 37: 983
[本文引用: 2]
[13]Jia Z, Dai C S, Chen L. Electrochemical Measurement Method [M]. Beijing: Chemical Industry Press, 2006
[本文引用: 1]
贾铮, 戴长松, 陈玲. 电化学测量方法 [M]. 北京: 化学工业出版社, 2006
[本文引用: 1]
[14]Cao C.
On electrochemical techniques for interface inhibitor research
[J]. Corros. Sci., 1996, 38: 2073
[本文引用: 1]
[15]Cao C N. Principles of Electrochemistry of Corrosion [M]. 3rd Ed., Beijing: Chemistry Industry Press, 2008
[本文引用: 1]
曹楚南. 腐蚀电化学原理 [M]. 第三版. 北京: 化学工业出版社, 2008
[本文引用: 1]
[16]Negm N A, Al Sabagh A M, Migahed M A, et al.
Effectiveness of some diquaternary ammonium surfactants as corrosion inhibitors for carbon steel in 0.5 M HCl solution
[J]. Corros. Sci., 2010, 52: 2122
[本文引用: 1]
[17]Negm N A, Kandile N G, Badr E A, et al.
Gravimetric and electrochemical evaluation of environmentally friendly nonionic corrosion inhibitors for carbon steel in 1 M HCl
[J]. Corros. Sci., 2012, 65: 94
[本文引用: 2]
[18]Poornima T, Nayak J, Shetty A N.
Effect of 4- (N,N-diethylamino) benzaldehyde thiosemicarbazone on the corrosion of aged 18 Ni 250 grade maraging steel in phosphoric acid solution
[J]. Corros. Sci., 2011, 53: 3688
[本文引用: 2]
[19]Lebrini M, Lagrenée M, Vezin H, et al.
Experimental and theoretical study for corrosion inhibition of mild steel in normal hydrochloric acid solution by some new macrocyclic polyether compounds
[J]. Corros. Sci., 2007, 49: 2254
[本文引用: 1]
[20]Hanza A P, Naderi R, Kowsari E, et al.
Corrosion behavior of mild steel in H2SO4 solution with 1,4-di [1′-methylene-3′-methyl imidazolium bromide]-benzene as an ionic liquid
[J]. Corros. Sci., 2016, 107: 96
[本文引用: 1]
[21]Musa A Y, Kadhum A A H, Mohamad A B, et al.
On the inhibition of mild steel corrosion by 4-amino-5-phenyl-4H-1, 2, 4-trizole-3-thiol
[J]. Corros. Sci., 2010, 52: 526
[本文引用: 1]
[22]Qiang Y J, Zhang S T, Guo L, et al.
Sodium dodecyl benzene sulfonate as a sustainable inhibitor for zinc corrosion in 26%NH4Cl solution
[J]. J. Clean. Prod., 2017, 152: 17
[本文引用: 1]
[23]Wang X M, Yang H Y, Wang F H.
A cationic gemini-surfactant as effective inhibitor for mild steel in HCl solutions
[J]. Corros. Sci., 2010, 52: 1268
[本文引用: 1]
[24]Hegazy M A, El-Tabei A S, Bedair A H, et al.
An investigation of three novel nonionic surfactants as corrosion inhibitor for carbon steel in 0.5 M H2SO4
[J]. Corros. Sci., 2012, 54: 219
[本文引用: 1]
[25]Ali S M, Al Lehaibi H A.
Control of zinc corrosion in acidic media: Green fenugreek inhibitor
[J]. Trans. Nonferrous Met. Soc. China, 2016, 26: 3034
[本文引用: 1]
[26]Satapathy A K, Gunasekaran G, Sahoo S C, et al.
Corrosion inhibition by Justicia gendarussa plant extract in hydrochloric acid solution
[J]. Corros. Sci., 2009, 51: 2848
[本文引用: 1]
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





