随着21世纪社会和工业的迅速发展,金属的服役条件变得越来越苛刻,腐蚀是困扰我国油气开采、炼化、建筑等工业发展中一个尤为突出的问题。采用缓蚀剂作为一种经济有效的防护技术被广泛地应用于各行各业中,并成为不可替代的重要防护措施[1,2,3,4]。我国目前使用的缓蚀剂主要有咪唑啉、曼尼希碱和季铵盐等几大类,其中曼尼希碱缓蚀剂合成简便、低毒、结构稳定,具有优异的缓蚀性能,因此在近年来的研究中备受重视。迄今为止,国内外在曼尼希碱缓蚀剂的开发和研究方面已经做了大量工作,传统研究主要集中在缓蚀剂的缓蚀性能、反应性及实验室研究等方面[5]。然而,这些研究很少关注缓蚀剂与金属表面的吸附行为和缓蚀机理。所以,在传统实验的基础上需要理论指导来完成缓蚀剂的研究或设计,采用实验与理论相结合的方法能深层次的探究缓蚀剂的缓蚀机理与吸附行为。
由于缓蚀剂分子和金属基体表面的相互作用过于复杂,以实验手段来进行研究具有较大难度,并且由于实验过程中的猜测使得研发过程具有一定的盲目性。近年来,随着计算机模拟水平的提高和理论的不断完善,分子模拟方法日趋成熟,已经发展成为一种从微观层面研究物质及相关过程的有效手段。采用分子动力学 (MD) 模拟可在分子水平上获取详细的动力学信息和阐明缓蚀剂分子与金属表面的具体吸附机理,为深层次探讨缓蚀机制提供了理论依据。使用MD方法研究缓蚀剂在金属表面的吸附已取得了一些有价值的研究成果[6,7,8]。本文以酮、醛、胺为原料合成了两种曼尼希碱缓蚀剂,在采用动电位极化曲线和电化学阻抗测试方法对缓蚀剂缓蚀性能研究的基础上,进一步使用分子动力学模拟手段深入探讨了缓蚀剂在Fe表面的吸附机理。采用实验和理论相结合的方法研究曼尼希碱缓蚀剂的缓蚀机理及吸附行为,以期为以后缓蚀剂的应用和研究开发、延长油气井及工业材料的寿命提供更可靠的技术和理论支持。
1 实验方法
实验样品为苯乙酮 (AR)、苯甲醛 (AR)、十二醛 (AR,月桂醛)、苄胺 (AR)、无水乙醇 (AR)、冰醋酸 (AR)。均为分析纯。
本研究合成了两种曼尼希碱缓蚀剂,分别为ZJ-1和ZJ-2。其中,以苯乙酮、苄胺和十二醛在C2H5OH作溶剂、CH3COOH作催化剂的条件下合成了ZJ-1曼尼希碱缓蚀剂,见图1a;以苯乙酮、苄胺和苯甲醛在C2H5OH作溶剂、CH3COOH作催化剂的条件下合成了ZJ-2曼尼希碱缓蚀剂,见图1b。
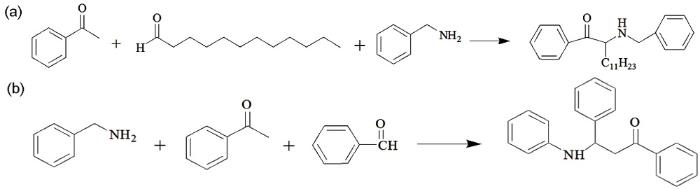
图1 ZJ-1和ZJ-2曼尼希碱缓蚀剂合成原理
曼尼希碱缓蚀剂的合成主要按照Mannich胺甲基化反应机理进行[9],ZJ-1所用原料苯乙酮、十二醛和苄胺与ZJ-2所用原料苯乙酮、苯甲醛和苄胺的摩尔比均为1∶1.1∶1。具体的操作方法如下:
采用FA1004型电子天平 (精确度0.0001 g) 称取41.80 g的十二醛 (23.58 g的苯甲醛) 加入到带回流冷凝管、恒压滴液漏斗和磁力搅拌器的250 mL三口烧瓶中,并加入少量的乙酸和无水乙醇分别作为催化剂和反应溶剂,晃动三口烧瓶使十二醛 (苯甲醛)、乙酸和无水乙醇混合均匀后再加入21.64 g的苄胺,将DF-101S型集热式恒温加热磁力搅拌器的温度调至30 ℃,恒温反应1 h。而后再加入少量的乙酸和24.15 g的苯乙酮升温至110 ℃,恒温反应数小时后,经过提纯得到棕红色液体产物,即曼尼希碱缓蚀剂ZJ-1 (ZJ-2)。采用Nexue傅里叶变换 (原位) 红外光谱 (IR) 仪对产物进行表征。
电化学测试采用CHI600E电化学工作站完成。实验温度为60 ℃,在1 mol/L NaCl+CO2的介质环境中,两种缓蚀剂各加入10 mg/L。电化学测试以三电极体系进行,辅助电极为铂电极,参比电极为Ag/AgCl电极,工作电极为P110钢 (除工作面外,其余面用环氧树脂封装,工作面积为1 cm2),测试前用600#,800#,1000#,1200#,1500#水磨砂纸逐级打磨工作面,至表面粗糙度≤1.6% μm,蒸馏水冲洗后用无水乙醇擦洗,吹干后待用。当自腐蚀电位稳定后进行极化曲线和电化学阻抗测试,极化曲线扫描速度为0.5 mV/s,电位扫描范围为开路电位±250 mV (相对于自腐蚀电位)。电化学阻抗谱 (EIS) 测试的频率范围105~10-2 Hz,阻抗测量信号幅值5 mV正弦波。缓蚀效率η可通过以下公式计算得到:
η=(I0corr-Icorr)/I0corr×100% (1)
式中,η为缓蚀效率;I0corr和Icorr分别为金属在未加缓蚀剂和添加缓蚀剂的溶液中的自腐蚀电流密度。
模拟工作均采用Material Studio7.0软件包进行。模拟过程中,力场模型选用源自量子力学从头计算的COMPASS力场,利用Visualizer模块构建缓蚀剂分子、铁晶体以及水分子模型,模型优化及MD模拟均通过Discover模块完成。模拟温度为333 K,采用Andersen恒温器进行温度控制,各分子起始速度由Maxwell-Boltzmann分布随机产生。截断半径取1.5 nm,在保证计算精度的前提下,模拟立方体边长应大于2倍的截断半径。有研究表明,Fe(001) 为稳定晶面,故选取Fe(001) 晶面为吸附表面,首先构建1个包含11层Fe原子的二维超晶胞,然后将其构建为3.153 nm×3.153 nm×1.433 nm三维超晶胞。同时,使用Amorphous Cell模块构建一个3.153 nm×3.153 nm×3.008 nm的液态水三维无定形单元 (包含1000个H2O分子),将构建好的缓蚀剂分子浸没进该无定形单元中,水和缓蚀剂分子位置随机确定,然后再构建尺寸为3.153 nm×3.153 nm×1.504 nm的液态无定形水层 (包含500个H2O分子)。将上述三部分叠加后得到界面体系模型,其中,将较薄的水层所有原子“冻结”用作隔离层,而使溶液中的分子保持与金属基体表面相互作用。模拟总时间为500 ps,模拟过程中时间步长为1.0 fs,每1000步输出一个轨迹文件,共输出500个轨迹文件。根据计算机模拟“缓蚀剂分子-腐蚀界面”体系达到平衡时的界面构型,获取其吸附能数据,对于评价缓蚀剂性能的好坏具有重要意义。吸附能的计算公式如下[10]:
Eadsorption=Emolecular+surface-(Emolecular+Esurface) (2)
式中,Eadsorption为缓蚀剂与铁表面的吸附能,Emolecular+surface为界面模型平衡态的总能量,Esurface为Fe(001) 表面的总能量,Emolecular为缓蚀剂分子的能量。本文所采用的吸附能计算方法与文献[15]有所区别,具体表现为Esurface能量值是界面平衡体系中去掉缓蚀剂分子后的剩余体系能量,Emolecular能量为界面平衡体系中去掉所有水分子和Fe表面后所得的缓蚀剂能量。
2 分析与讨论
2.1 曼尼希碱缓蚀剂的表征
图2分别为ZJ-1和ZJ-2曼尼希碱缓蚀剂的红外光谱。从图2可知,波数在3350 cm-1附近有一处单峰,为仲胺结构中—NH伸缩振动吸收峰,1357.64 cm-1左右的吸收峰为仲胺结构中C—N的伸缩振动吸收峰,在727.03 cm-1处出现了芳香族仲胺—NH的非平面摇摆振动峰,表明分子中存在仲胺结构;在1740~1715 cm-1附近没有出现饱和脂肪醛的特征吸收峰,表明产物中不含十二醛;波数在588.18 cm-1处的强吸收峰表明苯乙酮α-C位上的H原子被取代。以上分析表明,所合成的化合物即为目标产物。对ZJ-2曼尼希碱缓蚀剂分子红外光谱的分析也可得到相同的结论。
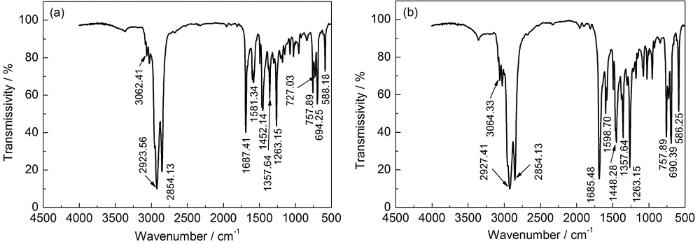
图2 ZJ-1和ZJ-2曼尼希碱缓蚀剂的红外光谱图
2.2 缓蚀效率及缓蚀作用机理
2.2.1 缓蚀效率
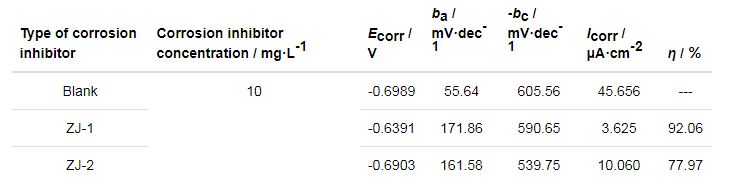
图3为P110钢在不同缓蚀剂溶液中的极化曲线,表1为P110钢在不同缓蚀剂溶液中的腐蚀电位、腐蚀电流密度及Tafel斜率的拟合结果。可知,相对于空白溶液,添加缓蚀剂后对P110钢有明显的缓蚀作用,当ZJ-1和ZJ-2曼尼希碱缓蚀剂均加入10 mg/L时,缓蚀效率分别为92.06%、77.97%。
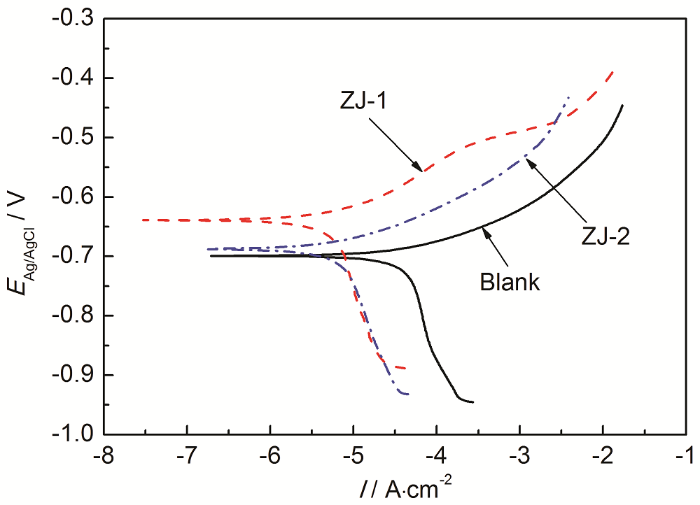
图3 P110钢在不同缓蚀剂溶液中的极化曲线
表1 P110钢在不同缓蚀剂溶液中的拟合电化学参数
2.2.2 缓蚀作用机理
由图3和表1进一步得出,相对于空白溶液,加入缓蚀剂后使P110钢电极的阳极 (ba) 和阴极 (-bc) Tafel斜率值均发生变化且阳极变化较大,腐蚀电位发生正移,其中ZJ-1曼尼希碱缓蚀剂的正移幅度较大。腐蚀电流密度明显降低,腐蚀过程中阴极反应和阳极反应都受到了抑制作用,但对阳极反应抑制作用较强,表明两种缓蚀剂是以阳极控制为主的混合型缓蚀剂,即缓蚀剂通过吸附使阳极反应和阴极反应都难于进行,导致金属表面上容易进行电极反应的面积缩小,从而降低反应速度以达到减缓腐蚀速率的目的[11,12]。此外,极化曲线结果还表明在该实验条件下ZJ-1曼尼希碱缓蚀性能更好。
图4为P110钢在不同缓蚀剂溶液中的电化学阻抗谱图及其等效电路图。等效电路中的Rs为溶液电阻,Cdl为整个金属电极表面/溶液之间的双电层电容,Rt为反应转移电阻,L是金属表面腐蚀产物覆盖区域阳极活化溶解导致的感抗,RL是感抗电阻,Cm和Rm为缓蚀剂吸附膜或腐蚀产物导致的容抗和电阻。相应的等效电路元件拟合参数见表2。
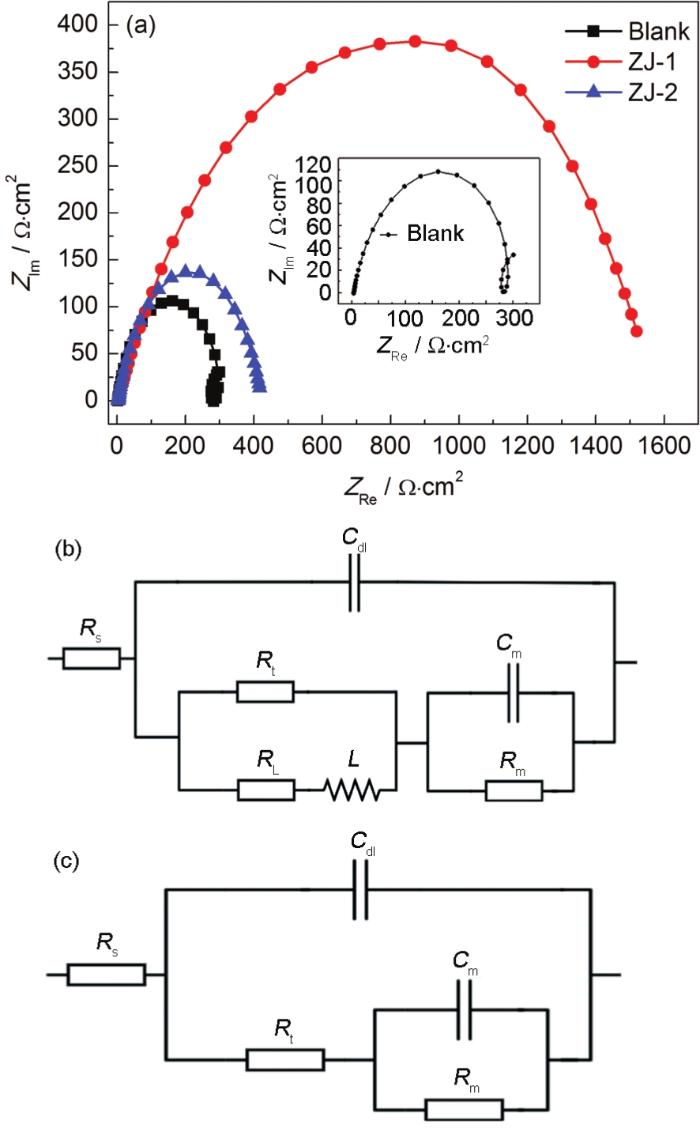
图4 P110钢在不同缓蚀剂溶液中的电化学阻抗谱图及其等效电路
表2 P110钢在不同缓蚀剂溶液中的各阻抗参数
从图4和表2可以看出,空白实验条件下的EIS图谱呈现3个时间常数,即高频区的容抗弧、低频区的感抗弧和容抗弧,其中高频区的容抗弧对应的状态变量为电极电位E,低频区容抗弧和感抗弧与阳极反应中间产物的吸附覆盖率和腐蚀产物在电极表面的聚集程度有关[11]。当添加缓蚀剂后,EIS图谱则呈现为2个时间常数,其高频区的容抗弧对应的状态变量同样为电极电位E,由于缓蚀剂分子可快速吸附在试样表面上 (两种缓蚀剂均为阳极控制为主的混合型缓蚀剂),因此,低频区容抗弧与缓蚀剂分子在整个电极表面的吸附覆盖率相关。
取ω→0的实部减去ω→∞的实部计算得出极化电阻Rp (见表2),结合反应转移电阻Rt、缓蚀剂吸附或腐蚀产物覆盖所导致容抗 (Cm) 和电阻 (Rm) 的变化关系,可以看出,添加缓蚀剂后,由于缓蚀剂分子吸附在电极表面,取代了介电常数较大的H2O分子[13],Cm明显减小,而Rt、Rm及Rp显著增大,P110钢电极反应阻力明显增强。由表2还可以看出,相比于ZJ-2曼尼希碱缓蚀剂,在添加ZJ-1曼尼希碱缓蚀剂的CO2溶液中,P110钢的电极反应极化电阻高达1821.79 Ω·cm2 (而在添加ZJ-2曼尼希碱缓蚀剂的CO2溶液中,其值仅为624 Ω·cm2),ZJ-1曼尼希碱缓蚀剂的加入使得电极反应阻力更大,缓蚀效果更好。
2.3 缓蚀剂分子在P110钢表面的吸附行为
2.3.1 缓蚀剂分子在Fe(001) 表面的平衡吸附构型
图5为液相条件下缓蚀剂分子在Fe(001) 表面的初始和平衡吸附构型。从图5a和b中可看出,经过MD模拟达到平衡后,从分子结构和吸附机理来看,ZJ-1曼尼希碱缓蚀剂分子中的O原子和苯环与金属表面吸附,长碳链呈现出平行吸附于Fe表面的构型。从图5c和d来看,经过MD模拟达到平衡后,ZJ-2曼尼希碱缓蚀剂分子中的N、O原子和两个苯环与金属表面吸附。ZJ-1和ZJ-2曼尼希碱缓蚀剂分子的活性原子为N和O原子,该活性原子通常易于给出电子,而Fe表面具有空电子轨道,使得该活性原子优先吸附在Fe(001) 表面,并带动整个缓蚀剂分子在Fe(001) 表面形成分子自组装覆盖效应。另外,ZJ-1和ZJ-2曼尼希碱缓蚀剂分子中均含有苯环,也是给电子基团,能提高其在金属表面的吸附性能。缓蚀剂分子中的活性原子或活性基团通过吸附在金属表面形成缓蚀剂分子膜,从而达到保护基体金属,阻止金属表面与腐蚀环境相接触,达到减缓或抑制腐蚀的目的[14,15]。
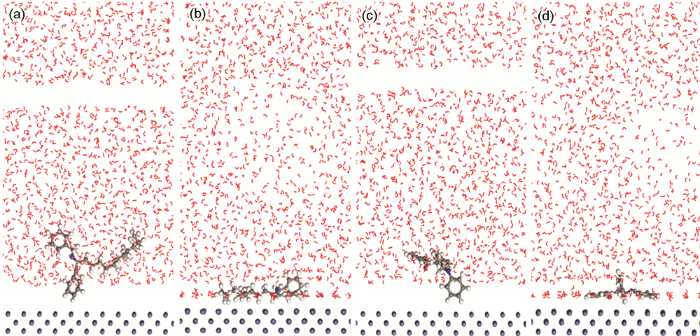
图5 ZJ-1和ZJ-2曼尼希碱缓蚀剂分子的初始构型和平衡吸附构型
2.3.2 吸附体系的平衡及吸附能
图6为ZJ-1和ZJ-2曼尼希碱缓蚀剂分子在Fe(001) 面上的温度和能量随时间变化的曲线。由图6可见,体系温度基本在 (333±10) K波动,可以认为体系已经达到温度平衡。经过一段时间后体系能量波动平缓,说明体系能量亦渐趋平衡。
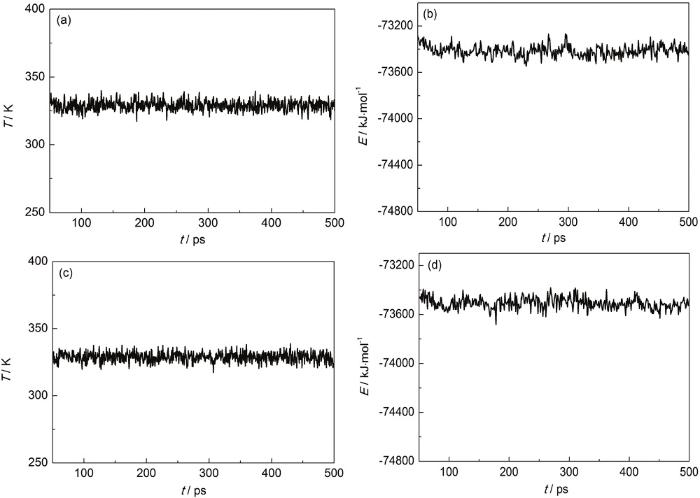
图6 ZJ-1和ZJ-2曼尼希碱缓蚀剂分子在Fe(001) 面上吸附的温度平衡曲线和能量波动曲线
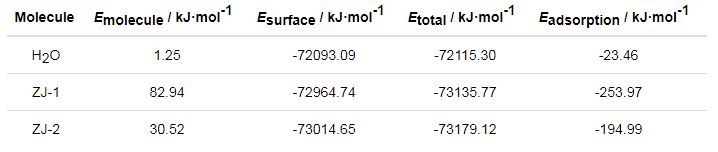
经过分子动力学模拟,得到ZJ-1和ZJ-2曼尼希碱缓蚀剂与Fe(001) 表面体系的吸附能,计算结果如表3。可见,ZJ-1和ZJ-2曼尼希碱缓蚀剂分子与Fe(001) 晶面的吸附能为负值,说明两种缓蚀剂分子均可自发地吸附在Fe(001) 晶面上;两种缓蚀剂分子吸附能的绝对值 (-253.97和-194.99 kJ/mol) 都明显比H2O分子 (-23.46 kJ/mol) 更大,说明两者均可以驱替水分子而吸附在金属表面,从而起到减缓腐蚀的作用。吸附能反映缓蚀剂分子与金属表面的结合强度,其数值越大,则缓蚀剂分子与Fe表面的吸附越稳定,缓蚀性能也越好[16]。因此,可以推断出ZJ-1曼尼希碱缓蚀剂在Fe表面的吸附成膜性要优于ZJ-2曼尼希碱缓蚀剂,这与前文中ZJ-1曼尼希碱缓蚀剂的缓蚀效率好于ZJ-2曼尼希碱缓蚀剂的实验数据也是一致的。
表3 缓蚀剂分子与Fe(001) 面的吸附能
3 结论
(1) 合成了两种曼尼希碱缓蚀剂ZJ-1和ZJ-2,较空白实验而言,添加缓蚀剂后有明显的缓蚀作用,在相应的腐蚀环境中,ZJ-1曼尼希碱缓蚀剂具有更好的缓蚀性能。
(2) 添加缓蚀剂后,腐蚀电位发生正移,且P110钢的阳极Tafel斜率值变化较大,对阳极抑制作用较为明显,表明ZJ-1和ZJ-2曼尼希碱缓蚀剂都是以抑制阳极为主的混合型缓蚀剂,作用机理为几何覆盖效应,腐蚀反应过程中的极化电阻增大,使腐蚀电流减小,腐蚀抑制性增强。
(3) 缓蚀剂分子在Fe(001) 面上吸附的温度和能量达到平衡后,吸附能均为负值,说明缓蚀剂分子可以自发地吸附在金属表面,实验数据和模拟数据都反映出ZJ-1曼尼希碱缓蚀剂具有较好的反应活性,缓蚀性能较好;ZJ-1和ZJ-2曼尼希碱缓蚀剂分子能够吸附在金属表面主要是由于其以O或N原子为活性中心,与Fe表面提供的空电子轨道相结合,吸附在金属表面形成较强的缓蚀剂分子保护膜,此外,苯环也是给电子基团,能提高其在金属表面的吸附性能。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





