摘要
采用失重法、极化曲线、电化学阻抗谱、扫描电子显微镜等方法研究了豆粕提取物 (SME) 作为植物缓蚀剂对Q235钢的缓蚀性能。结果表明,缓蚀剂在25~90 ℃范围内,随着温度升高,缓蚀效率先升高后降低。在温度为40 ℃,缓蚀剂浓度为0.8 g/L时,缓蚀效率达到92%。缓蚀剂对阳极和阴极都有抑制作用,属于混合型缓蚀剂。缓蚀剂分子在Q235钢表面的吸附符合Langmuir等温吸附模型,既有化学吸附也有物理吸附。
关键词: 豆粕 ; 植物缓蚀剂 ; Q235钢 ; 动电位极化曲线 ; 电化学阻抗谱
金属腐蚀问题具有普遍性和严重性,加入合适的缓蚀剂可以有效减缓金属的腐蚀状况[1]。Q235钢常用于锅炉、煤气、油田等领域,同时广泛应用于盐酸环境中,提高其在盐酸环境中的耐腐蚀性具有重要意义。
缓蚀剂的研究发展迅速,但大多数工业缓蚀剂对人类的生产、生活会带来危害,如铬酸盐、钼酸盐会造成环境污染等。研发出低毒无毒、经济绿色的缓蚀剂刻不容缓。植物缓蚀剂是一种优良的绿色缓蚀剂[2]。近年来,氨基酸类和黄酮类物质的植物缓蚀剂受到国内外学者的广泛关注,目前已有大量报道[3,4,5]。如Barouni等[4]研究了天冬氨酸、谷氨酸、亮氨酸等7种氨基酸在1 mol/L HNO3溶液中对Cu的缓蚀性能,得出蛋氨酸在同等条件下对Cu防护效果最佳。Li等[6]研究认为竹叶中的黄酮类化合物具有缓蚀作用,其缓蚀类型为阴极抑制型缓蚀剂,可对盐酸中Al的腐蚀产生明显的抑制作用。豆粕多用于农畜饲料,用途单一有局限性,导致了资源浪费,而其中含有大量的氨基酸与黄酮类物质[7,8,9],且其在金属防腐方面报道很少。因此,本实验通过失重法、电化学方法等研究了豆粕提取物 (SME) 在1 mol/L HCl溶液中对Q235钢的缓蚀性能,结合扫描电子显微镜 (SEM) 进行表面腐蚀形貌观察,论证豆粕提取物作为绿色缓蚀剂对Q235钢的缓蚀效果。
1 实验方法
1.1 材料及药品
实验试样为Q235钢,其化学成分 (质量分数,%) 为:C 0.12,Mn 0.36,Si 0.15,P 0.017,S 0.013,Ni 0.01,Cr 0.01,Fe 余量。将豆粕晒干,放置烘箱中80 ℃烘干48 h,粉碎后过800目标准筛,置于锥形瓶中待用。
1.2 豆粕提取物的制备
取10 g豆粕粉末,放入500 mL的70% (体积分数) 乙醇溶液中,恒温70 ℃浸泡3 h,真空抽滤后去除残渣,蒸发浓缩,得到提纯的SME。
1.3 红外光谱测试
采用Nicolette 6700型红外光谱仪 (FT-IR),对提取物中物质的分子结构、化学键进行分析,波数范围设置为4000~500 cm-1。将KBr碾磨成粉末,经压片机在15 MPa下压制5 min得到KBr薄片,再把SME涂覆于KBr片表面,置于FT-IR中进行分析测试。
1.4 失重法实验
试样钢片尺寸为:30 mm×15 mm×3 mm,使用金相砂纸 (400#-600#-800#-1000#) 依次打磨,后用无水乙醇和丙酮超声清洗,吹干。随后将3片钢片平行悬挂于可密闭的三口烧瓶中,放入300 mL含有不同浓度SME的1 mol/L HCl溶液中,恒温水浴锅控制温度,腐蚀浸泡4 h,清洗表面腐蚀产物,吹干后称重。计算平均腐蚀速率 (g·m-2·h-1) 和缓蚀效率 (η),公式如下:
vcorr=w0-w1St (1)
式中,vcorr为腐蚀速率 (g·m-2·h-1),w0和w1分别为Q235钢腐蚀前后质量 (g),S为试样的表面积 (m2),t为腐蚀时间 (h)。
η=vcorr0-vcorrinhvcorr0×100% (2)
式中,η为缓蚀效率,vcorr0和vcorrinh分别为未添加和添加缓蚀剂试样的腐蚀速率 (g·m-2·h-1)。
1.5 电化学实验
使用CS310型电化学工作站进行测试,采用传统三电极体系,饱和甘汞电极和Pt电极分别为参比电极和辅助电极,试样为工作电极。Q235钢试样尺寸为:30 mm×15 mm×3 mm,经砂纸打磨至1000#,使用丙酮和无水乙醇清洗,冷风吹干,硅胶封样,暴露面积1 cm×1 cm。将试样浸入腐蚀介质中30 min,直至开路电位稳定。实验温度为40 ℃ (应用环境温度),测试均进行3次,取平均值。极化曲线扫描区间为-0.4~+0.3 V (相对于开路电位),扫描速率为0.5 mV·s-1。利用CView2.0软件拟合得到腐蚀电流和开路电位,缓蚀效率计算公式如下:
η=Icorr-Icorr(inh)Icorr×100% (3)
式中,Icorr和Icorr(inh)分别为未添加和添加缓蚀剂的腐蚀电流密度 (A·cm-2)。
EIS扫描频率范围为105~10-2 Hz,交流信号振幅为10 mV。利用ZSimpWin 3.10软件对电化学阻抗数据进行拟合,得到加入缓蚀剂前后的极化阻值。缓蚀效率计算公式如下:
η=Rcti-Rct0Rcti×100% (4)
RP=Rs+Rct (5)
式中,R0ct与Rict分别为添加缓蚀剂前后的电荷转移电阻,Rs为溶液电阻,Rct为电荷转移电阻,Rp为极化电阻。
1.6 表面形貌观察及元素分析
将处理过的Q235钢分别放入空白HCl溶液和加入0.2 g/L SME的1 mol/L HCl溶液中,40 ℃、6 h全浸腐蚀后,清洗吹干。采用ZEISS EVO/MA15型扫描电子显微镜 (SEM) 观察Q235钢表面腐蚀形貌,同时用JSM-5900LV型能谱仪 (EDS) 对其进行EDS成分分析。
2 结果与讨论
2.1 红外光谱表征
豆粕提取物的FT-IR谱如图1。其中,3363 cm-1处的吸收峰为O—H的伸缩振动;2977 cm-1附近的吸收峰为C—H伸缩振动;1695 cm-1处的吸收峰为C=O的弯曲振动;1210 cm-1处的吸收峰为C—O伸缩振动;1385 cm-1处的吸收峰为—CH3的变形振动;681 cm-1附近的为芳烃C—H骨架的弯曲振动吸收峰[10,11,12]。
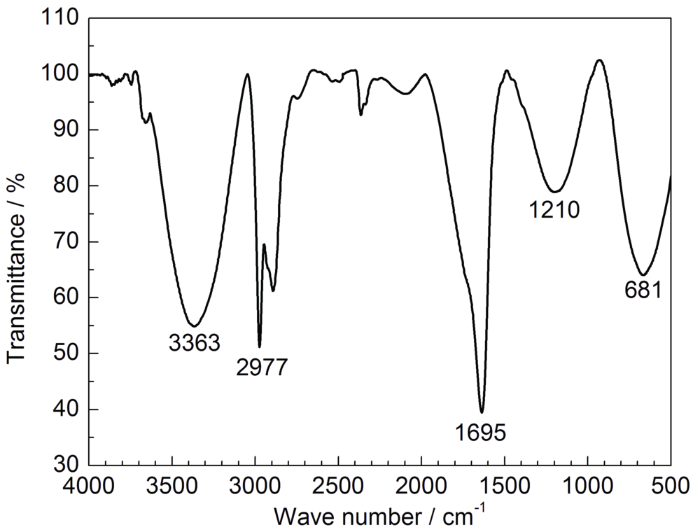
图1 豆粕提取物的FT-IR谱
2.2 失重实验
图2为Q235钢在25,40,55,70和90 ℃下,加入SME后,缓蚀效率与SME浓度的关系。可知,随着介质温度的升高,缓蚀效率先升高再降低,0.8 g/L、40 ℃时,缓蚀效率达到92%。这是由于,随着温度升高,溶液中分子的Brown运动加快,缓蚀剂分子反应活性提高,其吸附作用增强,SME可能依靠化学吸附与金属结合成膜,对金属形成保护作用[13]。温度持续升高时,金属的腐蚀反应速率常数增大,腐蚀介质向金属表面扩散速率加快,缓蚀剂分子在Q235钢表面上的脱附速率大于吸附速率,破坏了SME在金属表面形成的保护膜。另一方面,温度升高会破坏SME中的有效缓蚀成分,从而导致缓蚀效率逐渐降低。在90 ℃下1 mol/L HCl溶液中,碳钢的腐蚀速率为217.9 g·m-2·h-1;缓蚀剂浓度为0.8 g/L时,碳钢的腐蚀速率为38.1 g·m-2·h-1,缓蚀效率达82%。而在同一温度下,缓蚀效率随SME浓度的增大而升高。这是由于浓度增大,金属表面缓蚀剂分子覆盖比例增大,形成良好的保护膜,有效隔离了腐蚀介质,缓蚀效率升高。
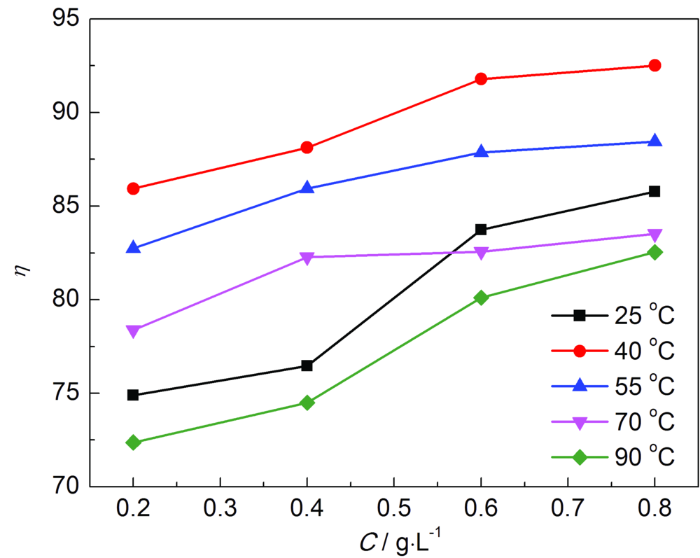
图2 Q235钢在不同温度下HCl溶液中的缓蚀效率随缓蚀剂SME浓度的变化
2.3 电化学实验
2.3.1 动电位极化曲线 图3为Q235钢在40 ℃下含不同浓度SME的1 mol/L HCl溶液中的动电位极化曲线。可以看出,添加SME后,自腐蚀电位 (Ecorr) 负移,腐蚀电流密度 (Icorr) 降低,阳极和阴极反应均得到了抑制;随着SME浓度的升髙,抑制作用增强。通过CView 2.0软件对曲线拟合得到Ecorr, Icorr,阳极斜率 (βa) 和阴极斜率 (βc) 等电化学动力学参数,如表1。缓蚀效率可以通过Icorr代入式 (3) 计算得到。
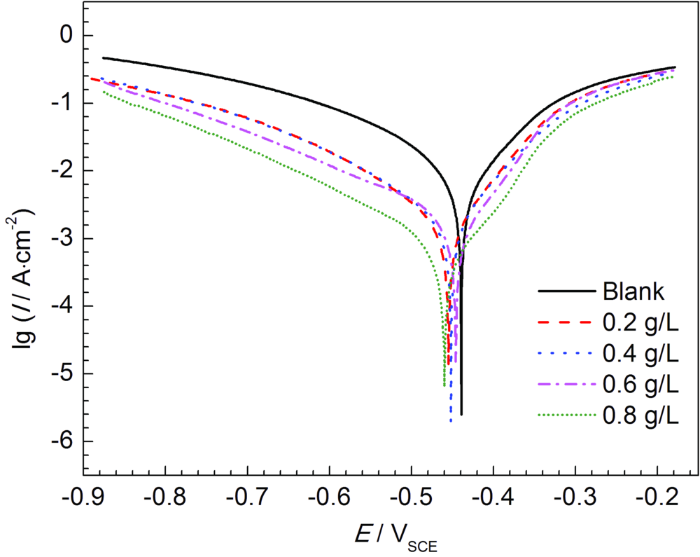
图3 Q235钢在40 ℃下含不同浓度SME的1 mol/L HCl溶液中的动电位极化曲线
表1 Q235钢在40 ℃下含不同浓度SME的1 mol/L HCl溶液中的动电位极化曲线参数
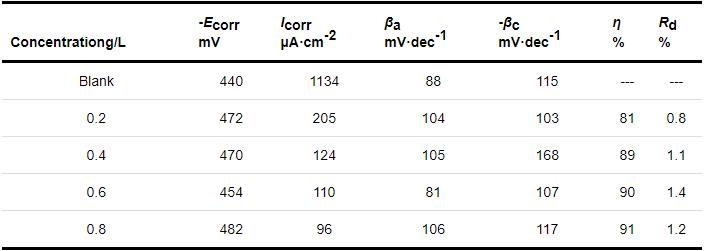
由表1可知,每组3次平行实验缓蚀效率计算结果相对标准偏差 (Rd) 为0.8%,1.1%,1.4%和1.2%,表明缓蚀效率计算值在误差范围之内。随着SME浓度增大,Ecorr变化最大差值为42 mV,其差值小于85 mV,说明SME应为混合型缓蚀剂[14,15]。Icorr逐渐减小,由1134 μA·cm-2减小至96 μA·cm-2,腐蚀速率明显降低。缓蚀效率随着SME浓度的增大而升高;在浓度为0.8 g/L时,缓蚀效率达91%,与失重实验结果基本一致。
2.3.2 电化学阻抗谱 图4为Q235钢在40 ℃下含不同浓度SME的1 mol/L HCl溶液中的电化学阻抗谱图。可知,Q235钢在含有不同浓度SME的 1 mol/L HCl溶液中Nyquist谱为扁平半圆形的容抗弧,说明Q235钢发生的腐蚀过程主要是在电极和溶液界面上的电荷转移过程[16,17]。随着SME浓度的增大,容抗弧半径增加,但弧的形状大致相同,说明腐蚀机理并未发生改变。Bode图中,加入SME后|Z|明显增大,说明相应的阻抗数值在增大。相位角图中随着SME浓度的升高,相位峰往负向移动,说明Q235钢表面缓蚀剂分子吸附的越多,成膜质量越好。此体系可用图5所示等效电路拟合。
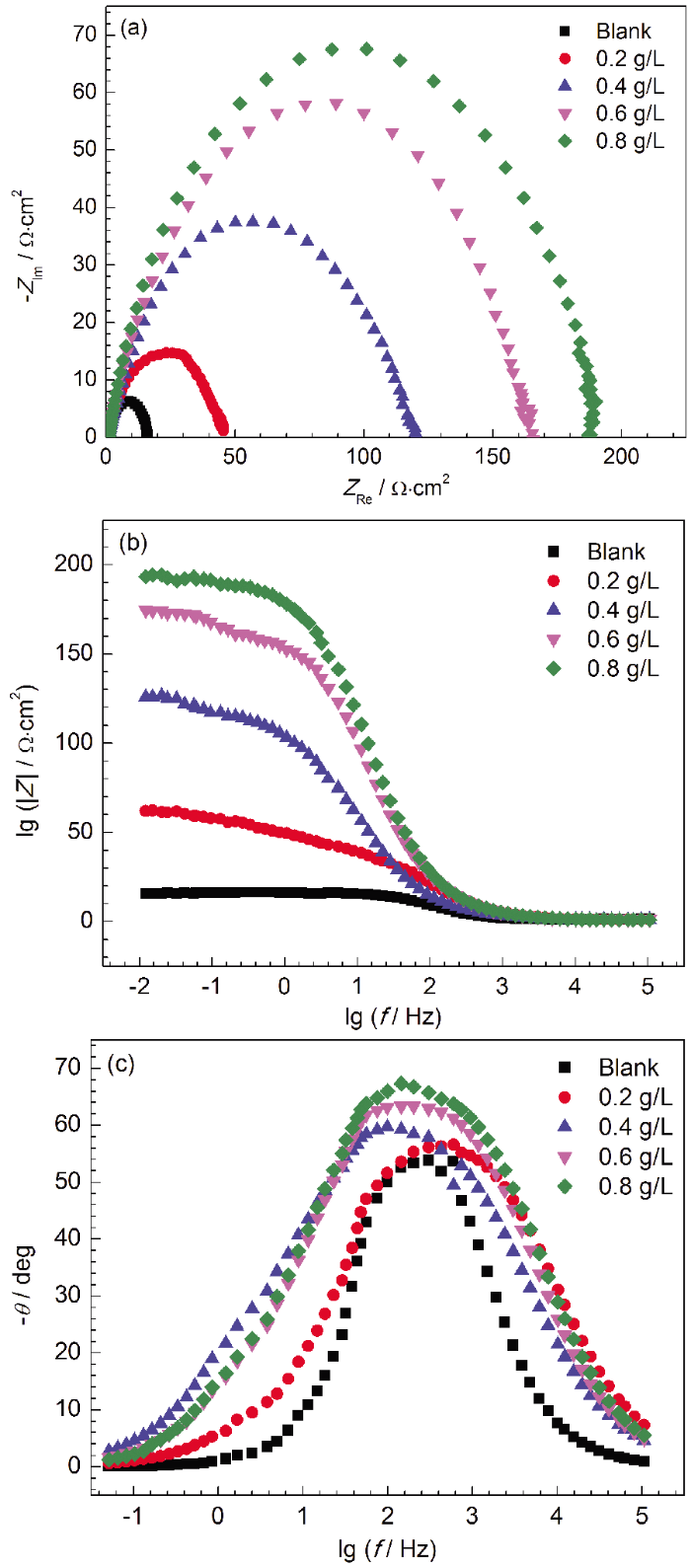
图4 Q235钢在40 ℃下含不同浓度SME的1 mol/L HCl溶液中的电化学阻抗谱
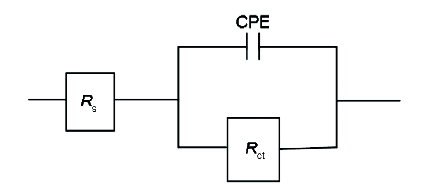
图5 等效电路图
图5中,CPE为常相位元件 (对应双电层电容Cdl),具体拟合参数如表2。Cdl可以用下式计算[18]:
表2 Q235钢在40 ℃下未加和添加不同浓度SME的1 mol/L HCl溶液中的电化学阻抗谱参数
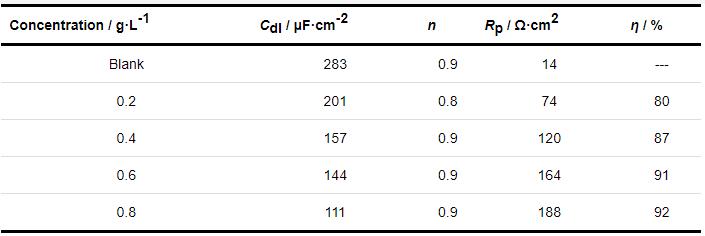
其中,Y0是一个比例系数,w是角频率,j2=-1是虚数。表2中的η为缓蚀效率,由式 (4) 得到。
由表2可知,随着SME浓度的增大,Rp值增大,由14 Ω·cm2增为188 Ω·cm2,说明金属发生腐蚀反应的阻力增大,腐蚀速率减小,缓蚀效率最高为92%。Cdl随着缓蚀剂浓度的增大而减小,表明缓蚀剂吸附使双电层的介电常数减小,或者是增加了其厚度,说明缓蚀剂分子在碳钢表面形成保护层。
2.3.3 吸附模型及热力学分析 假设SME缓蚀剂分子在Q235钢表面的吸附符合Langmuir吸附等温式[19]:
C/θ=1/Kads+C (8)
式中,覆盖度θ由失重法得的缓蚀效率IE (%) 表示,C为缓蚀剂浓度 (mol·L-1);Kads为吸附平衡常数 (L·mol-1)。以C/θ对C作图,结果如图6所示。
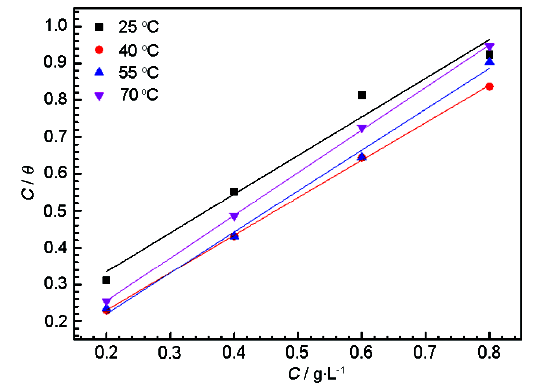
图6 不同温度下Q235钢在含不同浓度SME的1 mol/L HCl溶液中的Langmuir吸附等温模型
从表3中可以看出,各温度下拟合的线性相关系数R2≈1,直线斜率≈1,可认为SME缓蚀剂在Q235钢表面的吸附服从Langmuir等温吸附模型,缓蚀剂分子在Q235钢表面形成单分子层吸附,有效抑制了盐酸对Q235钢的腐蚀。
表3 不同温度下Q235钢在含不同浓度SME缓蚀剂的1 mol/L HCl溶液中的Langmuir吸附参数

吸附平衡常数Kads可由图6中直线的截距计算得到,再由下式可计算出吸附自由能 (ΔGads):
ΔGads=-RTln(55.5×Kads) (9)
式中,ΔGads为吸附自由能 (J·mol-1),Kads为吸附平衡常数 (L·mol-1),T为绝对温度 (K),R为气体常数 (8.314 J/mol·K),55.5为水的浓度 (mol·L-1)。
为进一步探究缓蚀剂分子在Q235钢表面的吸附,引入吸附焓 (ΔHads,kJ·mol-1) 和吸附熵 (ΔSads,J·mol-1·K-1),它们和Kads存在如下关系:
lnKads=-ΔHadsRT+ΔSadsR+ln55.5 (10)
以lnKads对1000/T作图,如图7所示,线性拟合后直线的斜率为-ΔHads/R,可得到ΔHads。ΔSads则可以通过热力学基本方程得到:
ΔSads=ΔHads-ΔGadsT (11)
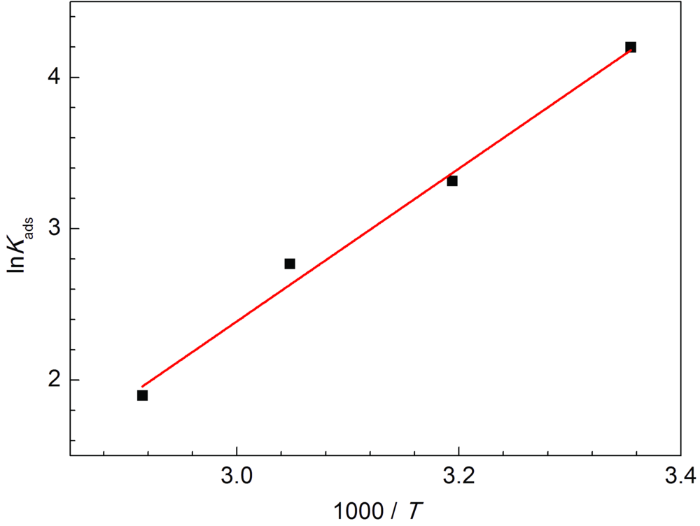
图7 SME缓蚀剂在Q235钢表面吸附的ln Kads与1000/T关系曲线
表4 Q235钢在不同温度下含SME缓蚀剂的1 mol/L HCl溶液中的吸附热力学参数
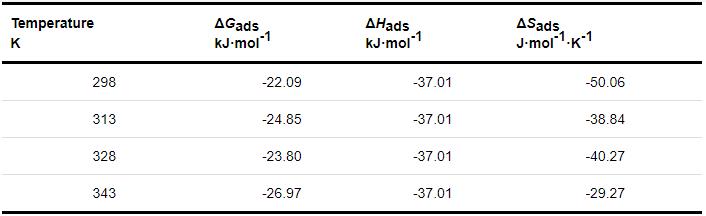
不同温度下,ΔGads<0,说明SME缓蚀剂在Q235钢表面的吸附过程是自发的[20,21]。若-40 kJ·mol-1<ΔGads<-20 kJ·mol-1,则认为该吸附既有化学吸附又有物理吸附[22,23]。因此,SME缓蚀剂在钢表面的吸附包括物理吸附和化学吸附。ΔSads<0,说明缓蚀剂分子在Q235钢表面吸附是放热过程,温度升高,不利于吸附。
2.4 表面形貌观察及元素分析
图8分别为Q235钢试样在40 ℃下1 mol/L HCl溶液中浸泡6 h前后的SEM像。可见,腐蚀前Q235钢表面光滑,打磨划痕清晰可见。在未添加缓蚀剂的1 mol/L HCl溶液中,Q235钢腐蚀严重,表面为凹凸不平的坑窝形貌[24]。添加0.2 g/L SME缓蚀剂后,不存在凹凸不平的形貌,表面腐蚀程度明显降低,证明SME的加入有效减缓了Q235钢在1 mol/L HCl溶液中的腐蚀。

图8 Q235钢在40 ℃下1 mol /L HCl溶液中腐蚀6 h前后的SEM像
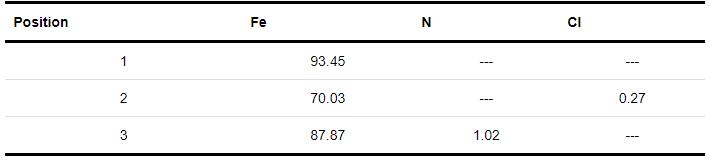
图9为Q235钢在40 ℃下1 mol /L HCl溶液中腐蚀6 h后的表面EDS成分分析结果。由表5可看出,腐蚀前图8a中位置1处可检测到Fe,含量为93.45%。在未添加缓蚀剂的1 mol/L HCl溶液中腐蚀6 h后,图8b中位置2处检测到Fe含量明显比图8c中位置3处加有缓蚀剂的表面的元素含量低,表面还含有少量Cl,说明Q235钢由于溶液中的Cl和溶解氧而受到腐蚀。加入SME后,图8c中位置3处Cl消失、Fe的比例升高,说明缓蚀剂分子在钢表面成膜,使得腐蚀产物大量减少,金属腐蚀过程受到抑制。
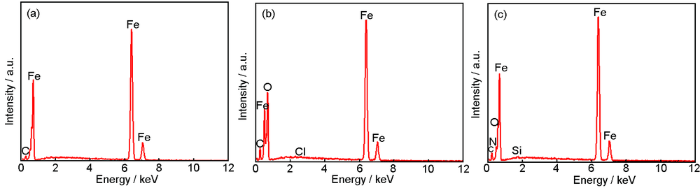
图9 Q235钢在40 ℃下1 mol /L HCl溶液中腐蚀6 h前后表面的EDS分析结果
表5 Q235钢腐蚀前后表面元素含量
3 结论
(1) SME的缓蚀效率随浓度增大而升高,随温度升高先升高后降低;40 ℃时添加0.8 g/L SME的缓蚀效率最高,达到92%,能够对Q235钢在1 mol/L HCl溶液中起到保护作用。
(2) SME是一种混合型缓蚀剂,对腐蚀过程中阴极和阳极都有保护效果。SME在Q235钢的表面吸附包含化学吸附和物理吸附,并符合Langmuir吸附等温式。
(3) ΔGads,ΔHads和ΔSads等数据表明,SME中的缓蚀分子在Q235钢表面的吸附为放热、熵减小的自发过程。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





