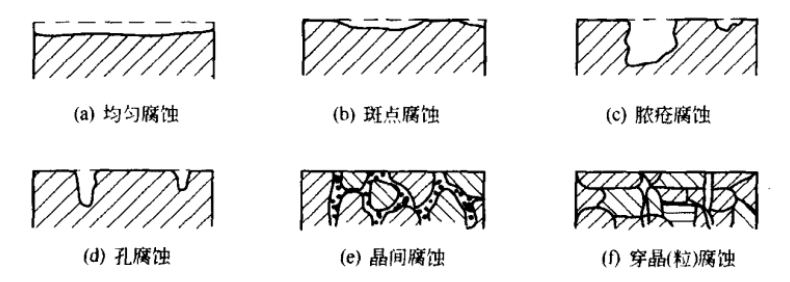
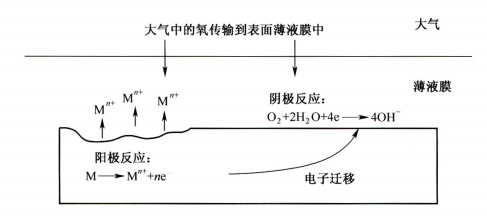
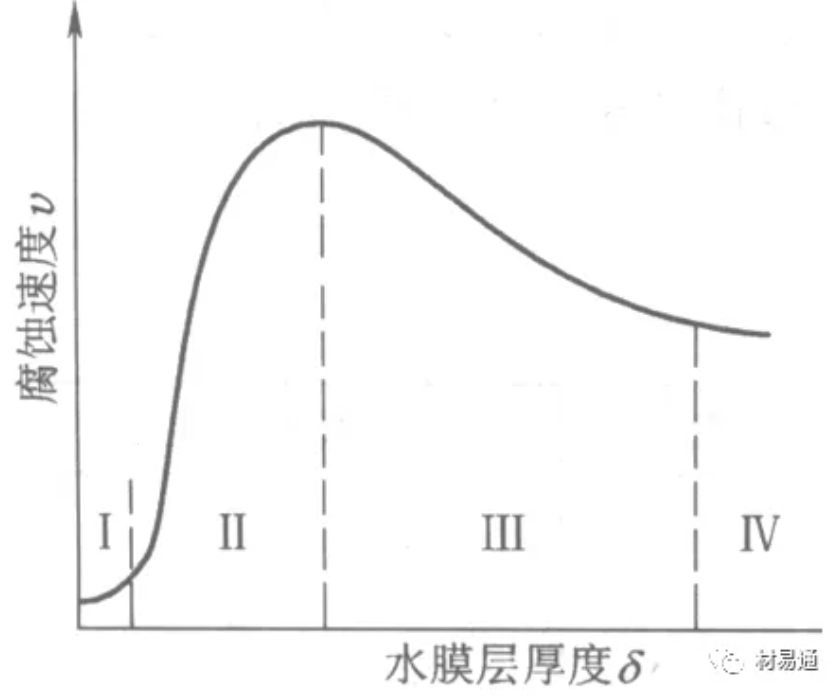
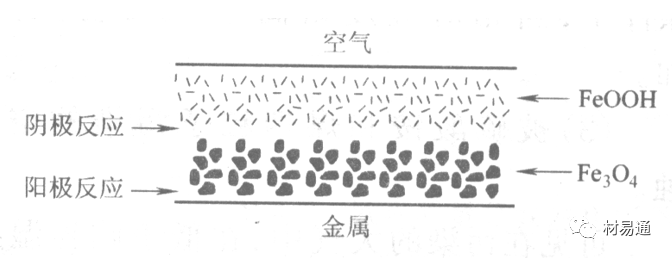
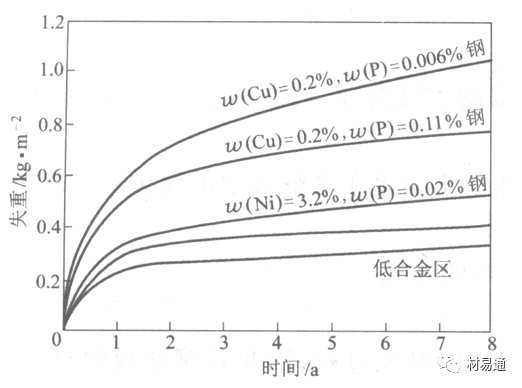
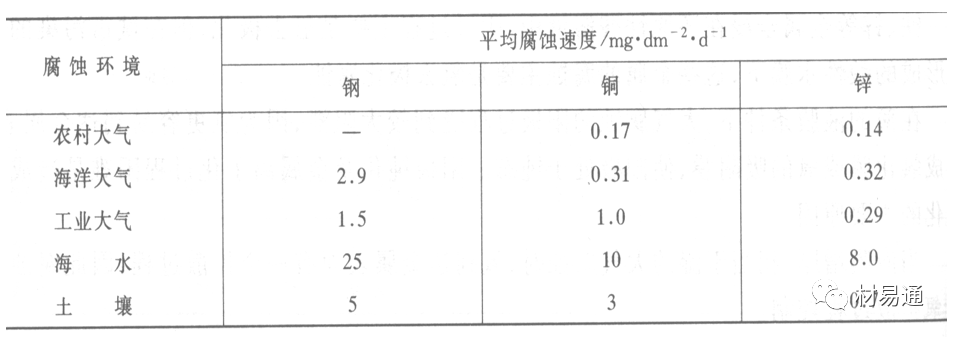
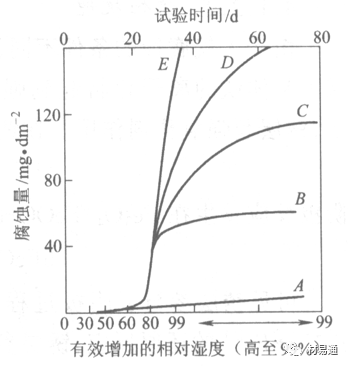
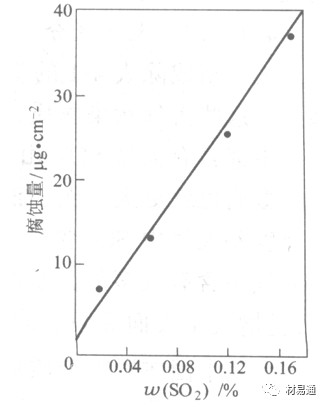
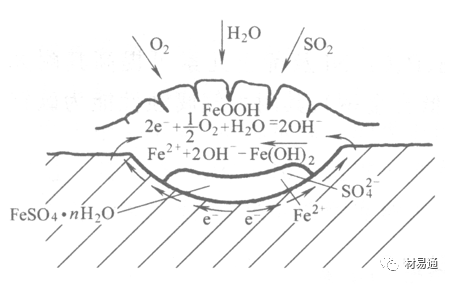
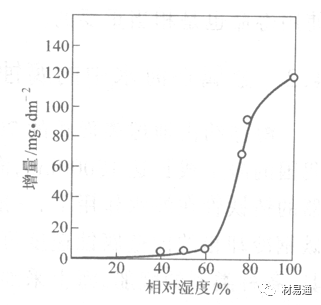
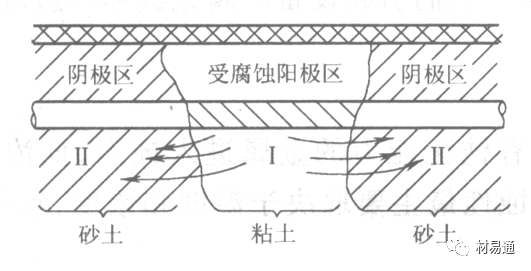
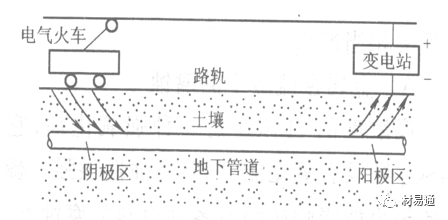
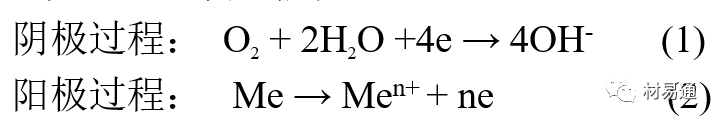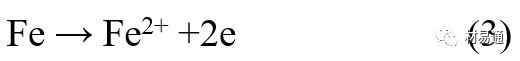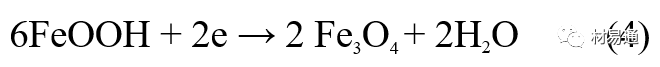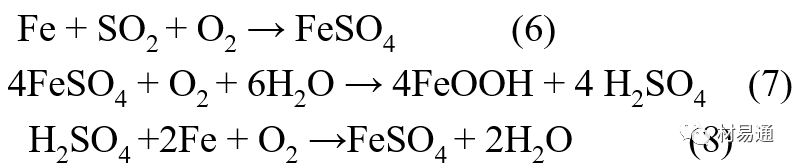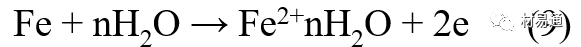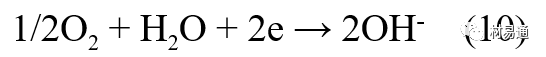引言:金属为什么会“生锈”? 我们生活中随处可见金属材料:桥梁、汽车、船只、输油管道、电器外壳……金属坚固、耐用,看起来“无坚不摧”,但其实它们也有一个致命弱点——腐蚀。所谓金属腐蚀,简单来说就是金属在空气、水或其他介质中发生了化学或电化学反应,被“慢慢吃掉”的过程。最常见的就是铁生锈,不仅影响美观,还会导致结构强度下降,甚至造成事故。 更棘手的是,不同的环境会导致不同的腐蚀方式。比如海边的钢铁容易被盐雾腐蚀、埋在土里的金属会被湿气和微生物侵蚀、工厂排出的酸性气体也可能腐蚀设备。金属腐蚀不仅关系到产品的使用寿命和安全性,更直接带来巨大的经济损失。据统计,全世界每年因腐蚀造成的损失高达数万亿美元!所以,了解金属在各种环境中的腐蚀情况、掌握防腐知识,不仅是工程人员的必修课,也越来越贴近我们的日常生活。 这篇文章将带你一起盘点——金属材料在各种环境中是如何被腐蚀的,又有哪些常见对策,让我们从源头了解这个“隐形杀手”。 金属腐蚀,听起来复杂,其实原理并不难理解。可以把它想象成金属在“氧气+水分+电解质”的环境中,被一点点“溶解”掉的过程。、 金属腐蚀本质: 我们来看看几种常见的腐蚀形式: 这是一种类似电池反应的过程。比如铁接触到水和空气后,表面就会发生氧化反应,生成铁锈。这种反应中,金属本身失去电子(被氧化),就像“自我牺牲”一样慢慢溶解掉。 关键条件:水分、氧气、电解质(比如盐)同时存在。 海边的钢铁为什么特别容易锈?因为空气湿润、含盐量高,腐蚀反应就像开了“加速器”。 有些金属即使不在潮湿环境中,也会发生腐蚀。例如高温下的金属会被空气中的氧或其他气体(如硫、氯)腐蚀,形成一层氧化膜或其他腐蚀产物。 虽然看上去不像铁锈那么明显,但时间久了,设备的强度和稳定性一样会大打折扣。 1)均匀腐蚀:整个表面慢慢变薄,最容易被忽视。 均匀腐蚀是最常见的一种腐蚀形式,表现为金属表面整体或大面积的均匀减薄。这种腐蚀虽然不会导致突然的设备故障,但长期下来会严重影响设备的结构强度和使用寿命。预防均匀腐蚀的关键在于选用耐腐蚀材料,并定期进行设备检查和维护。 2)点蚀:表面看起来没事,其实里面已经被“钻了洞”。 点腐蚀,或称孔蚀,是金属表面局部区域出现的腐蚀小孔。这种腐蚀形式往往难以预测,且可能在短时间内造成金属材料的严重损伤。点腐蚀通常发生在含有卤素离子(如氯离子)的环境中,因此,在这类环境中使用的设备需特别注意防范点腐蚀的发生。 3)缝隙腐蚀:比如螺丝缝里、水渍边缘,容易藏水的地方。 缝隙腐蚀发生在金属与金属或非金属之间形成的狭小缝隙内。由于缝隙内介质的不同于外部,容易形成浓差电池,从而导致腐蚀。预防缝隙腐蚀的方法包括减少或消除设备中的缝隙结构,以及使用耐腐蚀的密封材料。 4)晶间腐蚀:金属晶粒间被侵蚀,表面光滑但内部已酥。 晶间腐蚀是沿着金属晶粒边界发生的腐蚀。它不会使金属整体减薄,但会大大降低金属的机械性能。晶间腐蚀通常与金属材料的热处理工艺有关,因此,合理的热处理和合金元素的选择是预防晶间腐蚀的关键。 5)应力腐蚀开裂:在拉力和腐蚀同时作用下,金属会“突然断裂”。 应力腐蚀开裂是金属材料在应力和腐蚀环境共同作用下产生的开裂现象。它通常发生在高强度金属或合金中,且开裂前无明显预兆,危害性极大。防止应力腐蚀开裂需要综合考虑材料选择、结构设计、环境控制等多方面因素。 图1 几种腐蚀示意图 这些腐蚀类型看起来像“专业术语”,其实在现实中随处可见:车门边缘的锈斑、水管穿孔、电塔断裂……背后都有不同的腐蚀“套路”。 腐蚀,其实就是金属“回到自然”的过程——从精炼过的金属,慢慢变成原始的矿物状态。只不过,这个“返老还童”的过程,我们并不希望它发生在我们的桥梁、飞机、车辆和各种关键设备上。 所以,理解腐蚀原理,是做好防腐的第一步! 金属腐蚀不像一次性事故,它更像是“隐形杀手”。而它的“杀伤力”很大程度上,取决于它所处的环境。不同的环境,对金属的影响方式和腐蚀速度都大不相同。下面就来逐个盘点: 金属材料或构筑物在大气条件下发生化学或电化学反应引起材料的破损称为大气腐蚀。大气腐蚀是常见的一种腐蚀现象。全世界在大气中使用的钢材量一般超过其生产总量的60%。例如,钢梁、钢轨、各种机械设备、车辆等都是在大气环境下使用。大气腐蚀而损失的金属约占总的腐蚀量的50%以上,因此了解和研究大气腐蚀的机理、影响因素及防止方法是非常必要的。 图2 大气腐蚀机制 全球范围大气主要成分几乎不变的,其中的水分含量将随地域、季节、时间等条件而变化。参与大气腐蚀过程的是氧和水气,二氧化碳。根据金属表面的潮湿程度的不同,把大气腐蚀分为三类: 1)干大气腐蚀。 干大气腐蚀是在金属表面不存在液膜层时的腐蚀。特点是在金属表面形成不可见的保护性氧化膜(1~10nm)和某些金属失泽现象。如铜、银等在被硫化物污染的空气中所形成的一层膜。 2)潮大气腐蚀。 潮大气腐蚀是指金属在相对湿度小于100%的大气中,表面存在肉眼看不见的薄的液膜层(10nm~1μm)发生的腐蚀。如铁没受雨淋也会生锈。 3)湿大气腐蚀。 湿大气腐蚀指金属在相对湿度大100%,如水分以雨、雾、水等形式直接溅落在金属表面上,表面存在肉眼可见的水膜(1μm ~1mm)发生的腐蚀。 图3 大气腐蚀速度与金属表面水膜厚度的关系 根据上图解释腐蚀速度与水膜厚度的规律: 1)区域I 金属表面只有约几个水分子厚(1~10nm)水膜,还没有形成连续的电解质溶液,相当于干的大气腐蚀.腐蚀速度很小。 2)区域II 金属表面水膜厚度约在1μm时,由于形成连续电解液层,腐蚀速度迅速增加,发生潮的大气腐蚀。 3)区域III 水膜厚度增加到1mm时,发生湿的大气腐蚀,氧通过该膜扩散到金属表面显著困难,因此腐蚀速度明显下降。 4)区域IV 金属表面水膜厚度大于1mm,相当于全浸在电解液中的腐蚀,腐蚀速度基本不变。 通常所说的大气腐蚀是指在常温下潮湿空气中的腐蚀。 大气腐蚀特点是金属表面处于薄层电解液下的腐蚀过程,腐蚀规律符合电化学腐蚀规律。 当金属表面形成连续的电解液薄层时,大气腐蚀的阴极过程主要是氧去极化。 铁、锌等金属全浸在还原性酸溶液中,阴极过程主要是氢去极化,城市污染的大气所形成的酸性水膜下,这些金属的腐蚀主要是氧去极化腐蚀。 在薄液膜下,阳极过程受较大阻滞,氧更易到达金属表面,生成氧化膜或氧的吸附膜,使阳极处于钝态。阳极钝化及金属离子化过程困难造成阳极极化。 当液膜增厚,相当于湿的大气腐蚀时,氧到达金属表面有一个扩散过程,腐蚀过程受氧扩散过程控制。 潮的大气腐蚀主要受阳极过程控制; 湿大气腐蚀主要受阴极过程控制。 大气腐蚀条件不同,锈层成分和结构是很复杂的。Evans认为大气腐蚀的锈层处在潮湿条件下,锈层起强氧化剂作用,在锈层内阳极反应发生在金属/Fe3O4界面上: 阴极反应发生在Fe3O4/FeOOH界面上: 锈层参与了阴极过程,图2为Evans锈层模型图。 •由图可见,锈层内发生Fe3+→Fe2+的还原反应,锈层参与了阴极过程。 •锈层干燥时,外部气体相对湿度下降时,锈层和底部基体钢在大气中氧的作用下,锈层重新氧化成Fe3+的氧化物,在干湿交替的条件下,锈层加速钢腐蚀过程。•碳钢锈层结构一般分内外两层: •内层紧靠钢和锈的界面上,附着性好,结构较致密,主要由致密的带少许Fe3O4晶粒和非晶FeOOH构成; •外层由疏松的结晶α-FeOOH和γ-FeOOH构成。 锈层生成的动力学如图3所示,其曲线遵循幂定律; P—失重量;K—常数;t—暴露时间;n—常数。 工业大气中的SO2、NO2、H2S、NH3等都增加大气的腐蚀作用,加快金属的腐蚀速度. 石油、煤等燃科的废气中含SO2最多,在城市和工业区SO2的含量可达0.1~100mg/m3。 常用金属在不同大气环境中的平均腐蚀速度。 1)空气很纯时,腐蚀速度很小,随湿度增加仅有轻微增加。 2)在污染的空气中,空气相对湿度低于70%时,即便长期暴露,腐蚀速度也是很慢。但SO2有存在的条件下,当相对湿度略高于70%时,腐蚀速度急剧增加。 3)被硫酸铵和煤烟粒子污染的空气加速金属腐蚀。 图中A-纯净空气, B-有(NH4)2SO4, C-0.01%SO2, D-(NH4)2SO4+0.01%SO2, E-烟粒+0.01%SO2。 •污染Air,低于临界湿度,金属表面没有水膜,金属受化学作用引起的腐蚀,腐蚀速度很小。高于临界湿度,水膜的形成,电化学腐蚀,腐蚀速度急剧增加。 •大气中SO2对不耐H2SO4腐蚀的金属,如Fe、Zn、Cd、Ni的影响十分明显。呈直线关系上升。 SO2促进金属大气腐蚀的机制 •SO2的腐蚀作用机制是硫酸盐穴自催化过程。 •SO2促进金属大气腐蚀的机制,主要有两种方式: •一是部分SO2在空气中能直接氧化成SO3,SO3溶于水形成H2SO4; •二有一部分SO2吸附在金属表面上,与Fe作用生成易溶的硫酸亚铁,FeSO4进一步氧化并由于强烈的水解作用生成了H2SO4,H2SO4再与Fe作用,按这种循环方式加速腐蚀。 •整个过程具有自催化作用,即所谓锈层中硫酸盐穴的作用。 锈层中硫酸盐穴的作用 •Schwarz:锈层内FeSO4生成机构如图下所示的模型。锈层的保护能力受其形成时占主导地位的条件影响。如生成的锈层被硫酸盐侵蚀,锈层几乎无保护能力。相反,如最初锈层很少受硫酸盐污染,其保护性较好。 图5 锈层内FeSO4生成机构 •湿度 湿度是决定大气腐蚀类型和速度的一个重要因素。把大气腐蚀速度开始剧增时的大气相对湿度值称为临界湿度。对于铁、钢、铜、锌,临界湿度约在70%~80%之间。由图可见,湿度小于临界湿度,腐蚀速度很慢,几乎不腐蚀。若把湿度降至临界湿度以下,可防止金属发生大气腐蚀。 图6 铁在质量分数为0.01%的SO2的空气中经55天后 •大气成分 地理环境不同,有SO2、H2S、NaCl及尘埃等杂质。它们不同程度地加速腐蚀。特别是SO2。煤、石油燃烧的废气中都含有大量SO2, 冬季燃料消耗多,SO2污染更严重,对腐蚀的影响也就更大。 铁、锌等金属在SO2大气中生成易溶的硫酸盐化合物,它们的腐蚀速度和大气中SO2含量呈直线关系上升。 海洋大气中含有较多的微小的NaCl颗粒,它们落在金属的表面上,有吸湿作用,增大了表面液膜层的电导,氯离子本身有很强的侵浊性,因而使腐蚀变得更严重。 大气中固体颗粒称为尘埃。其组成复杂,除海盐粒外,还有碳和碳化物、硅酸盐、氮化物、铵盐等固体颗粒。城市大气中尘埃含量约2mg/m3,工业大气中的尘埃甚至可达1000mg/m3以上。 尘埃对大气的影响有以下几点: 1)尘埃本身具有腐蚀性,如铵盐颗粒能镕入金属表面的水膜,提高电导或酸度促进腐蚀。 2)尘埃本身无腐蚀作用,但能吸附腐蚀物质,如碳粒能吸附SO2和水气生成腐蚀性的酸性溶液。 3)尘埃沉积在金属表面形成缝隙而凝聚水分,形成氧浓差引起缝隙腐蚀。 防止大气腐蚀的方法: 1)提高金属材料的耐蚀性 在碳钢中加入Cu、P、Cr、Ni及稀土元素可提高其耐大气腐蚀性能。例如,美国的Cor-Ten钢(Cu-P-Cr-Ni系低合金钢),其耐大气腐蚀性能为碳钢的4~8倍。 2)采用有机和无机涂层及金属镀层。 3)采用气相缓蚀剂。 4)降低大气湿度, 主要用于仓储金属制品的保护。 土壤是由土粒、水溶液、气体、有机物、带电胶粒和粘液胶体等多种组分构成的极为复杂的不均匀多相体系。因土壤的组成和性能的不均匀,极易构成氧浓差电池腐蚀,使地下金属设施遭受严重局部腐蚀。埋在地下的油、气、水管线以及电缆等因穿孔而漏油、漏气或漏水。或使电信设备发生故障。这些往往很难检修,带来很大的损失和危害。 土壤腐蚀是一种很重要的腐蚀形式。先进国家,地下的油、气百万公里以上,每年因腐蚀损坏而替换的各种管子费用就有几亿美元之多。随石油工业的发展,研究土壤腐蚀规律,寻找有效的防蚀途径具有很重要的实际意义。 土壤特性 1)土壤多相性。土壤是由土粒、水、空气,有机物等多种组分构成的复杂的多相体系。实际的土壤一般是这几种不同组分按一定比例组合在一起的。 2)土壤导电性。由于在土壤中的水分能以各种形式存在,土壤中总是存在一定的水分,因此土壤有导电性。土壤也是一种电解质。土壤的孔隙及含水的程度又影响着土壤的透气性和电导率的大小。 3)土壤不均匀性。土壤中氧气,有溶解在水中,有存在于土壤的缝隙中。土壤中氧浓度与土壤的湿度和结构都有密切关系,氧含量在干燥砂土中最高,在潮湿的砂土中次之,而在潮湿密实的粘土中最少。这正是造成氧浓差电池腐蚀的原因。 4)土壤的酸碱性。 大多数土壤是中性的,pH值在6.0~7.5之间。 •有的土壤是碱性的,如我国西北的盐碱土pH值为7.5~9.0; •一些土壤是酸性的,如腐殖土和沼泽土pH值为3~6。一般认为pH值越低,土壤腐蚀性越大。 •大多数金属在土壤中的腐蚀都属于氧去极化腐蚀。 金属在土壤中的腐蚀与在电解液中的腐蚀本质是一样的。 以Fe为例: 阳极过程: •阳极反应速度主要受金属离子化过程难易程度控制。 •在pH值低的土壤中,OH-很少。由于不能生成Fe(OH)2,Fe2+离子浓度在阳极区增大。在中性和碱性土壤中生成的Fe(OH)2溶解度很小, 沉淀在钢铁表面上,对阳极溶解有一定的阻滞作用。土壤中含有碳酸盐, 可能在阳极表面生成不溶性沉积物,起保护膜的作用。土壤中氯离子和硫酸根离子能与Fe2+离子生成可溶性的盐,加速阳极溶解。 阴极过程: •在弱酸性、中性和碱性土壤中,阴极反应主要是氧的去极化作用。 •土壤中的水溶解氧是有限的,对土壤腐蚀起主要作用的是缝隙和毛细管中的氧。 •土壤中的传递过程比较复杂,进行得也比较慢。在潮湿的粘性土壤中,由于渗水能力和透气性差, 氧的传递是相当困难的,使阴极过程受阻。当土壤水分的pH值大于5时,腐蚀产物能形成保护层。 充气不均匀引起的腐蚀 这种腐蚀主要指地下管线穿过不同的地质结构及潮湿程度不同的土壤带时,由于氧浓度差别引起的宏观电池腐蚀,如图7。 图7 管道在结构不同的土壤中所形成的氧浓差电池 杂散电流引起的腐蚀 杂散电流是一种漏电现象。来源用直流电的大功率电气装置,电气铁路,电解及电镀、电焊机等装置。图8为杂散电流腐蚀实例示意图。 图8 杂散电流腐蚀实例示意图。 微生物引起的腐蚀 •对腐蚀有作用的细菌不多,其中最重要的是硫酸杆菌和硫酸盐还原菌(厌氧菌)。 •这两种细菌能将土壤中硫酸盐还原产生S2-,其中小部分消耗在微生物自身的新陈代谢上,大部分可作为阴极去极化剂, 促进腐蚀反应。 •土壤的pH值在4.5~9.0时,最适宜硫酸盐还原菌生长; •11 <pH值<3.5时,这种菌的活动及生长就很难了。 涂层(沥青、环氧) 阴极保护(牺牲阳极、外加电流) 土壤处理(排水、酸碱调节) 工业生产中的腐蚀环境通常更为严苛、多变,且腐蚀因素往往是多因素叠加的结果,包括高温、高压、强酸强碱、气体腐蚀、磨损和微生物等联合作用。因此,腐蚀在工业中常以更复杂、更剧烈的形式存在。 在化工行业中,腐蚀问题尤其突出。生产过程中使用大量的酸、碱、盐、有机溶剂和氧化剂,这些化学介质对金属具有强烈的侵蚀作用。以硫酸、盐酸和氢氟酸为例,它们对碳钢具有极强的腐蚀性。在温度升高或浓度变化时,腐蚀速率通常呈指数级上升,容易造成设备内壁穿孔、焊缝失效或密封失效。例如,在磷肥厂的酸解工段,储存和输送系统中常发生盐酸对碳钢储罐底部的局部腐蚀,形成肉眼难以察觉的“蚀坑”,最终可能导致介质泄漏或爆裂事故。此外,不锈钢虽然能在许多酸性介质中形成钝化膜而展现出较好的耐蚀性,但在含有氯离子的环境中,如盐酸或海水混合介质中,仍然可能发生严重的点蚀甚至应力腐蚀开裂(SCC),尤其是在焊接热影响区。 石油和天然气行业则面临另一类典型的腐蚀环境问题。原油和天然气中往往含有一定浓度的二氧化碳(CO₂)、硫化氢(H₂S)和水分,这些成分在一定温度和压力下会形成酸性水膜,对金属管线造成“甜腐蚀”(CO₂腐蚀)或“酸性腐蚀”(H₂S腐蚀)。二氧化碳在水中生成碳酸,导致碳钢设备在内壁形成腐蚀产物FeCO₃,如果该产物膜不致密或被高速流体破坏,腐蚀反应会持续加剧,导致穿孔。硫化氢则更具危险性,它能渗入金属晶界,在应力存在的条件下诱发硫化应力腐蚀开裂(SSC),这是管道和井下设备断裂的主要诱因之一。因此,许多油田必须采用具有更强抗SCC能力的特殊材料,如13Cr钢、超级双相不锈钢或镍基合金。此外,注入水中也可能因污染和微生物(如硫酸盐还原菌SRB)活动,导致严重的微生物诱导腐蚀(MIC),这类腐蚀常在管道低点、积水区或停流设备中发生,难以检测,失效往往是突发性的。 电力工业特别是热电厂中,腐蚀问题同样是长期难题。在锅炉系统中,水蒸汽环境温度高、氧含量低,但对金属的氧化能力却极强。水冷壁管常因高温氧化皮的周期性脱落而导致局部过热,进而引发应力集中和管壁破裂。同时,飞灰中含有的碱金属(Na、K)和硫化物会附着在高温受热面上形成低熔点腐蚀产物,加速炉管外壁的高温硫化腐蚀。在冷凝器系统中,尤其是使用海水或循环冷却水的系统中,金属管束容易受到含盐水的点蚀、缝隙腐蚀或氧浓差腐蚀影响。铜合金在这些环境中虽耐蚀,但其腐蚀产物一旦进入系统也可能造成二次污染。因此,一些新建电站已改用钛管或不锈钢管替代铜合金材料,并配合化学加药系统控制水质的pH和氧含量,从而降低腐蚀速率。 在冶金、水泥、矿山等重工业行业中,腐蚀问题更多体现为“腐蚀+磨损”的复合破坏机制。例如选矿车间的溜槽、泵体、搅拌槽等部位,不仅面临腐蚀性浆体的侵蚀,还受到高浓度矿浆的高速冲刷,导致腐蚀产物难以形成保护层,材料磨损速率远高于静态条件下的实验数据。此类场合常使用堆焊耐蚀合金层、陶瓷内衬或聚合物复合涂层作为防护手段,但使用寿命仍然有限,维修周期频繁,运维成本高昂。 相比之下,食品与制药工业虽然腐蚀条件相对温和,但其对设备材料的卫生性、表面洁净度及腐蚀后果控制更为严格。许多设备需定期使用酸性或碱性清洗剂(如NaOH、HNO₃、ClO⁻)进行CIP清洗,这种交替的酸碱循环、加上清洗死角内残液的不彻底清除,容易在焊缝或结构缝隙中形成Cl⁻富集区,进而导致不锈钢的点蚀甚至缝隙腐蚀。由于产品对金属离子的溶出高度敏感,设备一旦腐蚀,不仅影响质量,还可能因金属污染造成整批产品报废,损失远高于一般工业设备的故障。 工业环境中的金属腐蚀问题远比表面现象更为深刻,它往往是材料性能、介质成分、温度压力、流体状态、微生物活性及工艺管理等多种因素耦合下的结果。因其“不可见、进展快、危害大”的特点,腐蚀防控必须从系统设计阶段就引入综合策略,包括合理的材料选择、耐蚀结构设计、防腐蚀涂层、腐蚀监测系统、化学控制与运行维护一体化方案。只有这样,才能在现代工业生产中实现设备长期稳定运行、延长使用寿命、降低维护成本并提升本质安全水平。 在实际工程中,金属材料的选择直接决定了结构的耐久性和腐蚀防护的难度。每种金属或合金在不同环境中都具有特定的腐蚀敏感性与优势,其腐蚀行为既与材料本身的化学稳定性有关,也受环境中介质成分、温度、应力、流速等外部因素影响。 碳钢广泛应用于结构件、管道、压力容器等场合,价格低廉、力学性能好,但其化学稳定性差,在大多数含氧、水分或电解质的环境中易发生电化学腐蚀。 在大气、水、土壤、酸性气体等环境中,碳钢表现为均匀锈蚀;若存在缝隙、焊缝、涂层缺陷等结构特点,则极易发生点蚀和缝隙腐蚀。 在输送CO₂或H₂S气体的油气管线中,碳钢更可能出现CO₂腐蚀(形成FeCO₃)或酸性腐蚀下的硫化物应力腐蚀开裂。 必须结合阴极保护、内防腐涂层、缓蚀剂等系统防护 在腐蚀性高的场合需选用低合金钢(如Cr-Mo钢、Corten钢) 不锈钢的耐腐蚀性来自于其表面形成的一层富铬钝化膜(Cr₂O₃),在中性甚至弱酸性环境中具有良好稳定性。然而在含氯离子的环境中(如海水、消毒液、清洗液),钝化膜会被局部击穿,形成点蚀。 奥氏体不锈钢(如304、316)还可能在拉应力+Cl⁻环境下发生应力腐蚀开裂(SCC)。焊接部位由于元素偏析和晶粒粗化,更易发生晶间腐蚀,尤其在高温处理后未经固溶退火的不锈钢。 选择合适的不锈钢牌号而非“越贵越好” 避免焊缝热影响区应力集中,实施固溶热处理 适用Cl⁻场合建议使用双相钢或超级不锈钢 铝的表面自然形成一层Al₂O₃钝化膜,使其在大气、水、弱酸环境中具备良好耐蚀性。但在碱性溶液中(如NaOH清洗液)或氯离子富集区,其钝化膜极不稳定,易被迅速破坏,造成严重点蚀和缝隙腐蚀。 在潮湿+温热环境下,部分高强铝合金还会发生“剥落腐蚀”和“晶间腐蚀”,这是由于材料组织中析出的MgZn₂等析出相沿晶界聚集,形成腐蚀通道。 广泛用于航空航天、交通运输、电子壳体等领域,轻质优势突出,但对结构设计要求高。 阳极氧化处理提升钝化膜稳定性 避免使用碱性清洗剂或碱性水冷系统 结构设计避免积水和缝隙 铜在许多自然环境中具有较好耐蚀性,表面可形成Cu₂O保护膜,耐点蚀性能强。但在含氨、硫化物或低pH环境中,铜合金极易发生应力腐蚀开裂,尤其在高温湿热或闭合缝隙中。 黄铜、青铜等铜合金中的锌或锡组分可能因脱锌/脱锡而引起“选择性腐蚀”。此外,在含有Cl⁻和气泡扰动的水流中,铜还会发生汽蚀腐蚀和冲刷腐蚀。 常用于换热器、冷凝器、建筑管道、仪器接头等场合,尤其在微生物控制与热导率方面具有优势。 禁止用于含氨介质系统(如冷却塔) 加强流体净化,避免高流速冲刷 适当合金化(加铝、锡)提升整体耐蚀性 钛具有极强的化学惰性,几乎在所有氧化性环境中都能形成致密的TiO₂钝化膜,耐酸耐盐,甚至在王水中也能稳定存在。 然而,在某些强还原性介质(如无氧HF、熔融金属、干氯气)中,钛可能发生局部快速腐蚀。此外,钛在应力作用下,在特定卤素介质中可能产生氢脆或氯化应力腐蚀。 广泛应用于海洋工程、航天、化工、医疗植入材料等高端领域。 避免在高温Cl⁻气氛或浓氢氟酸中使用 对于植入用钛材料应确保表面精细抛光+钝化 航空结构中要考虑钛的氢脆敏感性 金属腐蚀问题自人类工业化以来始终存在,尽管已有大量工程经验和成熟的防护措施,但随着材料系统的复杂化、应用环境的极端化、工程设备的精密化,传统的防腐理论与技术正面临前所未有的挑战。与此同时,新材料、新技术和新理念的不断涌现,也正在为金属防腐领域注入新的活力。 以下是当前金属腐蚀研究与技术应用中呈现出的几个主要热点方向与未来趋势。 传统的腐蚀研究多依赖宏观腐蚀速率、失重法或失效分析进行评价,而未来的方向是向更精细化、原位化、动态化研究转变。 随着原子力显微镜(AFM)、扫描电化学显微镜(SECM)、X射线光电子能谱(XPS)、原位电化学拉曼和透射电子显微镜(TEM)等技术的发展,研究者可以在纳米尺度上观测腐蚀过程的初始行为、局部电子转移、钝化膜形成与破裂机制。这些手段有助于揭示例如点蚀诱导因子、晶界敏感性、非均匀电位分布等精细过程,是未来材料设计与服役寿命预测的重要支撑。 金属合金的研发仍然是材料防腐的核心路径之一。当前研究重点包括: 双相不锈钢与超级奥氏体不锈钢的优化设计,提升抗Cl⁻点蚀与SCC能力; **高熵合金(HEAs)**在极端温度与酸碱环境中的抗腐蚀潜力; 面向核工业与航天应用的Zr基合金、Nb合金、镍基复合材料等; 可用于医疗植入的生物钛合金、镁合金钝化处理技术。 未来合金开发将更加依赖于多尺度模拟与人工智能辅助材料筛选,通过计算加速合金成分与组织的优化设计。 传统防腐涂层以阻隔腐蚀介质为目标,但一旦局部破损,其保护效果迅速降低。未来的涂层研发朝着智能化、多功能化、自适应化方向发展。 当前热点包括: 自愈合涂层:嵌入微胶囊或纳米容器,一旦表面损伤即释放修复剂; pH响应型涂层:对酸化环境敏感,自动释放缓蚀剂; 导电聚合物涂层:同时具备防腐蚀与阴极保护能力; 仿生涂层:模仿自然界贝壳、荷叶的结构,提升防渗透与抗污染能力。 未来,纳米技术和智能材料将让涂层从“静态防护”转变为“动态感应+自调节”的防腐系统。 实际工程中的腐蚀环境远非单一因素主导,往往涉及温度、应力、电场、流体力学、微生物等多场耦合,导致传统实验数据难以外推到复杂系统中。 为此,未来将越来越多采用: 腐蚀行为的多尺度模拟(从原子层到设备结构) 基于机理的腐蚀寿命预测模型 人工智能算法在腐蚀速率预测、腐蚀类型识别中的应用 这些方法不仅能提前发现高风险区域,也有助于为设计阶段提供前馈决策,提升材料与结构的本质安全性。 随着环保法规日益严格,传统的含铬涂层、电镀镉、VOC含量高的涂料等逐步被限制使用。未来防腐技术的发展将遵循“绿色、高效、可回收”的理念。 主要发展方向包括: 无铬化转化膜(如锆基、钛基化学转化) 天然有机缓蚀剂(如植物提取物、糖醇、氨基酸类) 水性防腐体系(取代传统溶剂型环氧/聚氨酯) 可降解镁合金植入材料的缓蚀控制 这类技术在食品设备、饮用水系统、生物医用材料等对环境与健康高度敏感的场景中具有重要应用前景。 过去,腐蚀监测多依赖人工定期检查、腐蚀挂片等被动手段。如今,数字化腐蚀监测与数据分析正成为一大趋势,尤其在油气、海洋、轨道交通等“无人值守+高风险”环境中。 未来方向包括: 传感器阵列+无线数据采集系统 电化学阻抗谱(EIS)、线性极化法在线测量 数字孪生技术:为关键设备构建腐蚀“镜像”,实时评估健康状态 云端腐蚀数据库+AI决策辅助 这类技术的推广将大幅度提升腐蚀响应速度,减少维修时间与停机成本,实现“预测性维护”。 未来的金属腐蚀控制,不再仅仅是“涂上防锈漆”或“换种材料”那么简单,而是一种集成了材料科学、智能制造、人工智能与环境科学于一体的系统工程。从微观机理解析到宏观结构预测,从静态防护向智能响应转变,防腐技术正朝着“更精准、更智能、更绿色”的方向演进。 这一变革将不仅改变工业设备的服役寿命和安全性,也将深刻影响基础设施、能源安全、生物医学、航空航天等关键领域的材料选用与设计理念。
腐蚀特性
工程应用及对策
腐蚀特性
常见类型与差异
工程对策
腐蚀特性
工程应用
防护措施
腐蚀特性
工程应用
防护措施
腐蚀特性
工程应用
防护建议
总结展望
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414