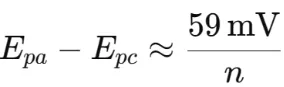循环伏安法(Cyclic Voltammetry, CV)是一种通过电位线性扫描并记录电流响应来研究电化学过程的基本技术。在 CV 中,电极电位以设定的速率在一个范围内往复变化,形成对称的三角波信号,进而驱动电极界面的氧化还原反应。通过记录电流-电位曲线(I-E 曲线),CV 能够提供反应的热力学、动力学和扩散等关键信息。
CV 的核心在于电极电位的动态控制和相应电流的记录。这一过程基于三电极体系的精准设计:工作电极施加电位变化,参比电极提供稳定的电位参考,对电极完成电流回路。在一次完整的三角波扫描中,电势从初始电位逐渐扫描至终止电位后反向返回,完成一个氧化和还原循环,形成经典的伏安曲线。
本文将围绕 CV 的核心原理展开,详细解析电位与电流响应的关系、扫描速率对数据的影响,以及法拉第电流和非法拉第电流的区别。此外,本文还将介绍 Randles-Sevcik 方程及其在扩散控制条件下的应用,探索氧化还原峰、峰电流及峰面积等特征背后所揭示的物理化学信息。这些内容将为理解循环伏安法在电化学研究中的重要性提供理论基础,并为后续的实验设计与数据分析奠定坚实的理论框架。
1 循环伏安法简介
1.1 循环伏安法的基本定义
循环伏安法(Cyclic Voltammetry, CV)是通过对工作电极施加线性扫描电位,记录与电位相关的电流变化来分析电化学行为的一种方法。其核心特性在于通过电流-电位曲线(I-E 图),捕捉氧化还原反应的动力学与热力学信息,为研究电化学过程提供了强有力的工具。
图表来源:Mohammad R, Abrams D J, Cardinale L Z A S S.Cyclic voltammetry and chronoamperometry: mechanistic tools for organic electrosynthesis[J].Chemical Society Reviews, 2024, 53(2):566-585.
在电化学领域,CV的应用十分广泛,从简单的氧化还原反应分析,到复杂的材料表征、催化性能评估和腐蚀行为研究,都有CV的身影。与其他电化学方法相比,CV具有以下优势:
▶操作简单:通过参数设置,可以快速获得氧化还原反应的全貌。
▶数据丰富:单一实验即可提供热力学、动力学及扩散行为等多方面信息。
▶灵活性高:可通过多循环扫描探测动态过程,还可以结合其他方法如电化学阻抗谱(EIS)或原位表征技术扩展应用范围。
1.2 循环伏安法的历史背景
CV 的起源可以追溯到 20 世纪初。最初,它是作为线性扫描伏安法(Linear Sweep Voltammetry, LSV)的延伸技术开发的。早期的研究主要集中在简单的氧化还原体系中,通过手动扫描电位和记录电流信号完成实验。
然而,20 世纪中叶,随着电化学理论的发展和高精度仪器的出现,CV逐渐成为电化学研究的核心工具。其中,Randles 和 Sevcik 的工作奠定了 CV 的理论基础:
▶Randles-Sevcik 方程用于定量描述扩散控制反应的峰电流。
▶现代电化学工作站的发明,如 Autolab 和 CHI 系列仪器,使得高分辨率数据采集成为可能,进一步推动了 CV 的普及。
目前,CV 已不仅局限于传统的无机氧化还原反应研究,其应用范围涵盖了新能源、电化学传感、生物化学和腐蚀科学等多个领域。
1.3 循环伏安法的理论基础
CV 的实验设计基于以下两个核心电化学概念:
▶法拉第电流(Faradaic Current):由电极表面发生的氧化还原反应产生,与电子转移过程直接相关。
▶非法拉第电流(Non-Faradaic Current):由电极表面双电层电容充放电产生,与化学反应无关。
在 CV 实验中,法拉第电流是研究的重点,其大小、方向和变化趋势反映了界面氧化还原反应的本质。CV 测试的结果通常以电流-电位曲线呈现,其中包含以下关键信息:
●氧化还原峰:由电化学反应产生,峰电位反映反应的热力学特征。
●峰电流:与反应物扩散速率、电极表面积和电子转移动力学相关。
●循环特性:通过多次扫描观察电流-电位曲线的变化,评估界面的稳定性或反应的可逆性。
1.4 循环伏安法的应用范围
CV 的应用广泛且多样,以下是几个典型领域:
▶腐蚀研究
CV 可用于分析金属表面的氧化还原行为,例如铁或锌的钝化膜稳定性。在研究腐蚀机理时,CV 可以通过峰位变化监测腐蚀产物的生成或破坏过程。
○案例:研究锌铝镁(ZAM)镀层钢板在盐雾条件下的电化学行为,通过CV曲线中的氧化峰位推测钝化膜的组成。
▶材料表征
CV 广泛应用于锂电池、超级电容器等能源材料领域,用以评估电极材料的可逆性和比容量。
○案例:评估钴氧化物薄膜电极的氧化还原活性,观察循环中 CV 曲线面积的变化以衡量材料的循环稳定性。
▶催化剂研究
CV 可用于研究电催化剂的活性,例如析氢反应(HER)或析氧反应(OER)的催化剂性能。
○案例:分析钼基催化剂的 HER 活性,观察在特定电位范围内的氧化还原行为,并通过峰面积评估催化活性位点的数量。
▶生物传感与电化学分析
CV 用于研究生物分子的氧化还原反应,例如葡萄糖、酶或DNA的电化学行为。
○案例:通过修饰电极表面研究DNA分子在不同氧化还原状态下的电子转移特性。
1.5 循环伏安法的优势与局限性
▶优势
○信息丰富:单次实验即可获取热力学、动力学及扩散相关信息。
○适用范围广:对固体、液体及界面反应均适用。
○直观性强:通过 CV 曲线的形态和变化,可以快速判断反应的特性。
▶局限性
○受限于分辨率:在复杂体系中,多个重叠反应可能导致数据解析困难。
○环境影响显著:如溶液电导率、温度等实验条件对数据有显著影响。
○需结合其他技术:CV 的数据往往需要与其他方法(如 EIS 或原位表征技术)结合,才能全面揭示反应机理。
循环伏安法作为电化学研究的经典方法,以其简单的实验操作和丰富的数据呈现成为电化学界的核心工具。通过合理设计实验参数,CV 能够在多领域中揭示氧化还原反应的核心规律。接下来,本文将从原理、实验设置与优化、数据解析及应用案例等方面进一步探讨 CV 的科学内涵与应用前景。
2 循环伏安法的核心原理
2.1 电极电位的线性扫描原理
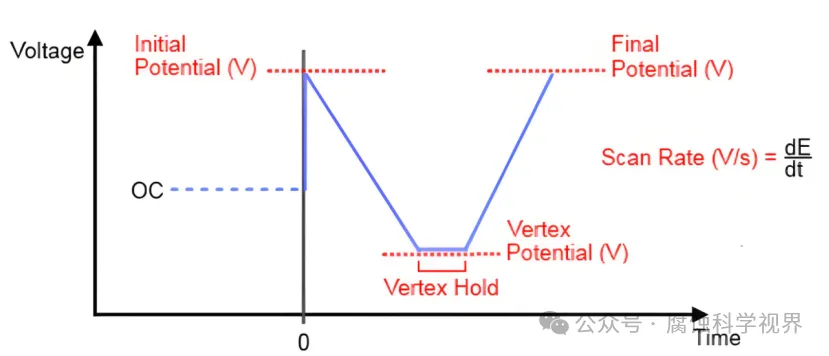
在循环伏安法(CV)中,工作电极的电位以线性速率在设定的范围内往复变化,形成对称的三角波信号。这种电位的动态变化驱动了电极界面的氧化还原反应,从而生成对应的电流信号。电极电位的控制和电流响应的记录构成了CV的基本实验框架。
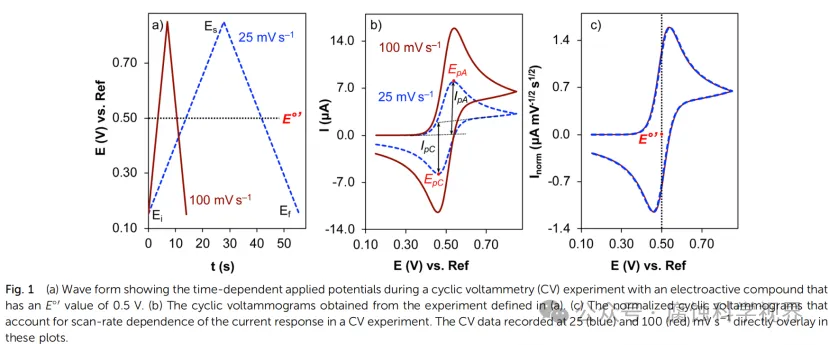
CV的测量原理是使电势在工作电极上作三角波扫描的同时,即电势以给定的速率u从起始电势Ea扫描到终止电势Ex后,再以相同速率反向扫描至Eo,并记录相应的电流-电势(i-E)曲线,也称伏安曲线 ,入为电势换向时间。电势与时间的关系可表示为:E=Eo+ut。式中,u为扫描速度,t为扫描时间。在一次三角波电势扫描过程中,完成一个氧化和还原的循环过程,故称为循环伏安法。
2.1.1 电位控制机制
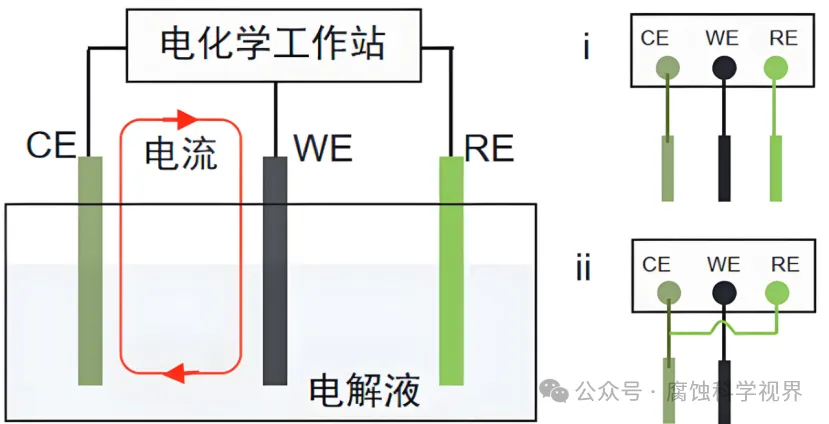
CV 实验中使用的三电极体系能够精确控制电极电位:
工作电极(Working Electrode, WE):施加电位变化的主体,是反应发生的主要场所。
参比电极(Reference Electrode, RE):提供稳定的参考电位,确保工作电极的电位精确可控。
对电极(Counter Electrode, CE):完成电流回路,通常由高导电材料(如铂丝或石墨)制成。
通过电化学工作站,工作电极电位以线性速率扫描,扫描范围通常覆盖氧化和还原过程的电位区间,例如从 −1.0 V-1.0V 的区间。
2.1.2 扫描速率的影响
扫描速率(ν)是 CV 实验的重要参数之一,它决定了氧化还原过程的响应时间:
○慢速扫描(ν≤10 mV/s):有助于探测反应的热力学信息,例如氧化还原电位的精确测定。
○快速扫描(ν≥100 mV/s):适合研究瞬态过程和动力学行为,例如表面吸附过程。
实际应用中,扫描速率的选择需根据目标反应的特性和研究目的进行优化。
2.2 界面反应与电流响应
CV 中的电流信号主要来源于电极界面的两种过程:
法拉第电流(Faradaic Current):由电极表面的氧化还原反应引起,与电子转移直接相关。
非法拉第电流(Non-Faradaic Current):由双电层电容充放电产生,与化学反应无关。
2.2.1 法拉第电流的特性
法拉第电流反映了界面氧化还原反应的本质,其大小受以下因素影响:
○扩散:反应物从溶液体相扩散到电极表面的过程。
○电子转移速率:由电极与反应物之间的界面动力学决定。
○反应可逆性:可逆反应中,电子转移速率足够快,法拉第电流呈现对称峰值;不可逆反应中,峰值发生位移且峰电流减小。
2.2.2 扩散控制与动力学控制
CV 中的反应过程可以根据主导因素分为两类:
○扩散控制反应:电流大小由反应物向电极扩散的速率决定,表现为峰电流 (ip) 与扫描速率的平方根 (ν1/2) 成正比。
○动力学控制反应:电流大小由界面电子转移速率决定,通常与扫描速率呈线性关系。
2.2.3 Randles-Sevcik 方程
扩散控制条件下,法拉第电流可以通过 Randles-Sevcik 方程描述:
通过此方程,可以定量研究反应物的扩散特性及界面反应的动力学信息。
2.3 电流-电位曲线的特征
CV 测试的结果通常以电流-电位曲线(I-E 图)呈现,曲线的形态反映了电化学反应的主要特性。以下是 CV 图谱中的几个关键特征:
2.3.1 氧化还原峰
在 CV 曲线中,电位扫描至氧化还原反应发生时,会出现明显的电流峰:
○氧化峰(Epa):对应电极表面发生氧化反应的电位。
○还原峰(Epc):对应电极表面发生还原反应的电位。
○峰电位差(ΔEp=Epa−Epc):反映反应的可逆性,理想可逆反应中 ΔEp≈59 mV/n。
2.3.2 峰电流与反应物浓度
峰电流的大小与溶液中反应物的浓度成正比,因此 CV 常用于定量分析:
在已知扩散系数和电极面积的情况下,可以通过峰电流计算溶液中反应物的浓度。
2.3.3 多循环特性
多次扫描可揭示反应的动态行为,例如电极材料的表面变化或吸附行为。以下是常见的多循环特征:
○可逆反应:氧化和还原峰保持对称,峰电流和峰面积基本稳定。
○不可逆反应:随着循环次数增加,峰电流逐渐减小或峰位置发生位移,表明反应产物对电极表面的覆盖效应。
2.4 理论模型与数学描述
为了进一步解析 CV 图谱,通常需要结合数学模型对实验数据进行拟合和解释。
2.4.1 可逆反应的数学描述
对于可逆反应,峰电位和峰电流的关系可以通过以下公式描述:
n:转移电子数。
理想情况下,可逆反应的氧化还原峰对称分布,且峰电位差为常数。
2.4.2 扩散控制的动力学模型
在扩散控制条件下,峰电流与扫描速率平方根的关系为:
通过对峰电流和扫描速率的关系作图,可以区分扩散控制与动力学控制的主导机制。
2.4.3 Tafel 方程
对于动力学控制的不可逆反应,Tafel 方程用于描述电流与电位的关系:
结合 CV 数据和 Tafel 方程,可以进一步量化界面的电子转移速率。
循环伏安法的核心原理基于电位的线性扫描和对应的电流响应。通过电流-电位曲线的特征分析,可以定量研究氧化还原反应的动力学和热力学性质。无论是可逆反应的热力学信息,还是不可逆反应的动力学行为,CV 都提供了丰富的数据支持。下一部分将详细讨论实验设计与参数优化,确保测试结果的科学性和可靠性。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414