《丰金属常温分解水制氢反应原理探秘》:与南阳氢水车老总庞青年、董仕节教授商榷
李达刚
中国科学院兰州化学物理研究所退体研究员
为什么现在发表此文,是因为近年来国内科技领域出现某些怪现象,例如有的研发项目稍有点研究进展,不顾产品产业化的经济性和实际价值,就开始做产品做示范,其中不少人是为了骗到钱,达快速致富发财。而且在中国产业界有成果慌之时,就可能会变成为某些“能人”借科技创新允许失败的名义走捷径骗钱之实,令真正科研者气愤!
2019年5月23日南阳青年汽车宣称:“车辆只需加水就能行驶”引起舆论暴发,因为对铝合金制氢原理不透明,产生巨大争议。其间,欢呼铝/水常温制氢之催化剂功效神奇者不少;但质疑又产生了一个《水变油骗钱事件》呼声更高。新华社和人民日报也都发声,科技日报或因厂家保密也末言明此产氢原理,更令人疑虑重重。“南阳氢水车事件”到底是重大的科技进步?还是高级骗钱之术?一时难以断定。因而许多人呼之: “以举国之力搞个清清楚楚!”、呼唤中科院发声等不绝于耳。如何判断“南阳氢水车事件”?涉及科学向题还是须用科学事实回答才会有说服力。
其实对此问题中国早已有过研究,最先申报于中国发明专利,申请号:2007100168498,专利名称:《丰金属常温分解水或重水制氢或氘的方法》,之后又发布于中国发明专利ZL 2011 10266145.2,对铝合金制氢的应用及原理早己有说明。现公开“常温分解水制氢反应机理”的发掘过程及中国笫一份有关“常温分解水制氢”的发明专利获得授权之经历故事,就可以清清楚楚说明白“铝合金水解制氢”的化学反应原理。能够让关心人士做出较准确的判断,推动这场全国科技创新大讨论更健康发展。
本文未章提出的几点结论与南阳洛特斯新能源汽车公司负责人庞青年、专利发明人董仕节教授二位商榷。不妥之处请与指正。
(一)从《意外发现》到《原始创新》
介绍丰金属常温分解水制氢的原始发明过程。
一个意外的发现:1993年在中科院兰州化学物理研究所改进SHOP法乙烯齐聚制α-烯时,用缓释长效的还原剂金属锌(Zn)代替瞬间还原剂硼氢化钠,组成由:中心金属:NiCl2;膦配体:Ph2PCH2COONa;还原剂:Zn;溶剂:丁二醇HOCH2CH2CH2CH2OH构成四元体系,意外的发现生成大量的氢气,而且在室温的条件下就能产生氢气。
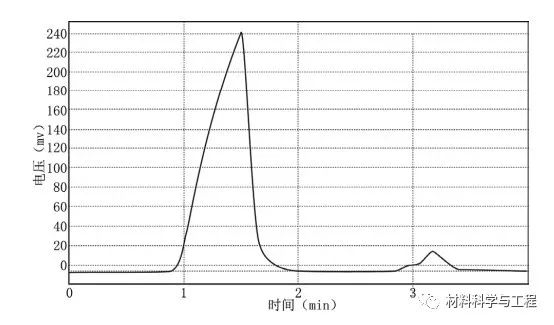
图1.产物氢气的毛细管气相色谱分析图
(二)查明氢的来源
在由锌/有机膦/丁二醇/氯化镍组成的四元体系中,只有丁二醇分子中含有活泼氢原子,为了确认氢来源于醇,考察了醇结构对产氢速率的影响,结果得出: 1)产氢速率与醇类的酸性呈顺变关系,见表1。
2)与膦配体的存在与否无关的结果。
表1 醇类产氢速率与解离常数关系
产氢速率 甲醇>乙醇 =丁二醇 >丁醇 >异辛醇 >> 叔丁醇 解离常数pKa 15.5 16 16.8 18 19.2 产氢最低温度℃ 10 15 15 30 70 不产氢
由上表可见,醇类溶剂产生氢气的最低温度与醇类的解离常数(pKa值)次序呈顺变关系。也就是说甲醇的羟基中氢最易解离,(pKa值最低)产氢最容易,生成氢气气泡的初始温度也最低(10℃);而叔丁醇的酸性最弱(pKa值最高),即它的羟基中氢最不易解离,在室温下,甚至提高到70℃也无氢气生成。 用二甲基亚砜代替醇类作溶剂,因它无羟基,无可解离的氢原子, 故不能产生氢。为氢气来源于醇的羟基找到了证据。
(三)用水代替醇制氢成功
醇类可看做烷基水, 因烷基的给电子能力除甲基外通常小于氢的给电子能力,醇与水相比较,其羟基氢较不易解离,液态醇的氢离子浓度大约为十亿分之一, 而液态水的氢离子浓度为千万分之一。 水的pKa值为15.74, 与甲醇相当。据此, 提岀用水代替醇组成:锌/水/氯化镍三元新体系,进行常温分解水制氢的试探。试验结果表明:丰金属(Al、Mn、Zn、Fe) / 金属盐类 / 水三元体系,在10-60℃常温条件下即可产生氢气。
(四)探索扩展
盐类产氢速率次序可排列为:FeCl3 > CrCl3 >MgCl2> AlCl3 > NiCl2 > FeSO4 > CuSO4 > 》 NaCl。
其水合离子[M(H2O)6]3+的解离常数pKa值为:
Fe[(H2O)6]3+ [Cr(H2O)6]3+ [Al(H2O)6]3+ [Cu(H2O)6]2+ [Fe(H2O)6]2+ 2.2 3.9 4.9 8.0 8.3
比较以上两个排列次序可见, 两者似乎呈逆变关系, 也就是水解常数越小, H+离子越易解离, 产氢速率越高。Na+离子的pKa值大于14-15, 无水解能力。金属种类的考察结果表明:非活泼金属在该三元体系中的产气能力大体与金属的活泼次序一致。
非活泼金属的活泼次序:铝、锰、锌、铬、鉄、钴、镍、锡、铅、氢、铜、银、金实验产氢次序:Mn > Zn > Al > Cr >Fe >Co> Ni > Sn。
其例外是金属锰(Mn)的产氢性能大大优于排在前边的金属铝(Al),更大大优于排在后边的锌(Zn)。查明,其原因是金属铝在生成氢气的过程中,铝表面同时生成氧化铝保护膜;而金属锌表面同样易生成碱式碳酸锌保护膜所致。金属活泼次序排列在氢原子之后的铜(Cu)与银(Ag)、金(Au)不能在该三元体系中产生氢气。
(五)《原始发现》的确认
本人检索了近50年(1955年-2005年)美国化学文摘索引及世界专利索引,均未见由金属锌/醇/氯化镍组成的三元体系,进一步扩展为非活泼金属/醇(或水)/金属盐类组成的三元体系也未见到可在室温下持续产生氢气的报导。初步确认此乃原始发现。
新发现的这种产氢现象与现有制氢方法相比,具有:
1) 不需外加能源,室温条件下即可产生氢气。
2) 不必用强酸或强碱,无腐蚀。
3) 氢气中无任何杂质,无须分离可得到纯氢。
4) 对环境无污染。
若能将此发现转化为技术发明,无疑将会为人类增添一种新的制氢方法。为了圆梦探索最终结果,2003年非典期间就在自家的车库里进一步开展丰金属常温分解水制氢反应机理的研究。(见照片)

丰金属常温分解水制氢中国笫一发明人李达刚, 1936年生,中科院兰州化物所退休研究员
(六)制氢原理探索----知识组合的创新
俗语云:“小鸡不撒尿,总是有条道” ,要把这条道找出来。从三元体系中的金属产氢能力与金属活泼次序大体一致的规律,可知金属Zn参与了还原氢质子的经典反应:
Zn + 2 H+ →Zn2+ + H2(g) 反应式<1>
反应式<1 >中的H+ 可来源於水自身的解离反应, 然而在Zn/H2O的二元体系下不能生成氢气(H2 ), 是因为在标态下, 水的解离常数很小, 仅为1.08×10-14 , 故在室温下不能产氢。那么,三元体系中的氢质子从那儿来的呢?从三元体系中盐类的产氢能力与金属离子水合物的水解反应常数呈逆变关系可知,该三元体系中发生了经典的水解反应:
[Fe(H2O)6]3+→ [Fe(H2O)5(OH)]2++ H+ PKa=3.05 反应式<2>
[Fe(H2O)5]2+→ [Fe(H2O)4(OH)2]+ + H+ PKa=3.26 反应式<3>
将反应式<1>与反应式<2>和反式<3>组合在同一个系统,即可将释放岀来的H+离子还原为气态氢(H2)。本文的偶然发现, 恰好将金属还原和盐类水解两个经典反应组合在同一个系统,故可在常温下产岀气态氢(H2)。常温制氢的总反应式可归纳为:
M3+ + xH2O ? [M ( H2O) x ]3+ [M ( H2O)x ] 3+
[ M ( H2O) x-2( OH )2]+ + 2H+
2H+ + m m2++ H2 (g)
M3++xH2O + m ?[ M ( H2O)x-2 (OH) 2]+ + m2++ H2(g) <总反应式1>
式中M3+:代表三价金属离子; m:代表零价金属。
(七) 抑制副反应
在锌/水或甲醇/氯化镍三元体系中,于室温下产生氢气的同时发现金属锌表面生成大量黑色沉积物,阻断了制氢反应的进行。
详情请点击链接查看:《与南阳水氢发动机商榷:丰金属常温分解水制氢》
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62313558-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





