核能是一种清洁能源,核能发电排放的温室气体量仅为传统化石燃料的1/50[1]。近几十年来我国核能行业迅速发展,核电厂在满足全国供电需求的同时,也将产生大量的核废料,据估算,截止到2020年,这些核废料总量约83000 t HM[2],因此,需要将这些核废料妥善处置。其中,高放射性废物(HLW)由于放射性水平高、半衰期长、热量大、毒性大等[3~5]特点需要进行永久处置以避免危害人类生活。目前各国认可的处置高放废物的方式为深地质处置。2006年,我国发布了首个高放废物地质处置的政府文件《高放废物地质处置研究开发规划指南》,并计划在2050年建成中国高放废物处置库(DGR)[6]。经过多年考察,我国已经选择甘肃北山地区为建造深地质处置库的预选场址[7]。
在DGR中会经历从初期的有氧、高温环境到后期氧含量降低至接近为零,温度逐渐下降20℃左右的漫长演变过程[4],核废料的放射性降低到原来铀矿的放射水平也需要近万年时间[8~10]。因此金属储罐作为使核废料与外界环境完全隔离的屏障之一,其设计使用寿命需要达到万年以上[11]。在金属储罐的候选材料中,Cu和碳钢被研究的最多。碳钢因其硬度大、塑性好、腐蚀行为可预测、价格低廉等优点被许多国家选为候选材料,如法国、瑞士、日本和比利时等国家;Cu因为有良好的耐蚀性,且相比其他耐蚀性金属,Cu在含有Cl-的溶液中通常发生均匀腐蚀,被加拿大、芬兰、瑞典等国家选用候选材料[12]。目前,我国暂未确定金属储罐的制作材料,近几年对低碳钢在深地质环境中的腐蚀行为研究较多[13~16],但碳钢的缺点是耐蚀性较差。加拿大曾提出在碳钢表面镀一层铜镀层以提高金属储罐的耐蚀性[17],镀铜钢储罐结合了碳钢和铜的优点,可以作为金属储罐的候选材料之一。但是当铜镀层表面出现缺陷时,内部碳钢暴露,铜和碳钢在地下水溶液中存在发生电偶腐蚀的风险,加快金属储罐的腐蚀失效速度。因此,若选择镀铜钢作为我国金属储罐材料,需充分考虑铜和碳钢在北山地下水环境中的电偶腐蚀。
我国北山地区地下水中主要的侵蚀性离子为
1 实验方法
实验所用金属材料为T2铜合金和Q235钢,均购自山东晟鑫科技有限公司。T2铜合金的化学成分(质量分数,%)为:Zn 0.005,Pb 0.005,Sn 0.002,Ni 0.005,Fe 0.005,Sb 0.002,S 0.005,As 0.002和Cu余量,Q235钢的化学成分(质量分数,%)为:C 0.181,Si 0.208,P 0.041,S 0.035,Al 0.266,Mn 0.552,Cu 0.167和Fe余量。采用线切割的方式将两种金属材料加工成高度为5 mm,直径不同的圆柱形金属试样,其中T2铜合金的直径分别为25.3和56.6 mm,Q235钢的直径为4和8 mm,通过组合不同面积的铜合金和碳钢,形成不同面积比的电偶对。选择试样的任一圆形面为工作面,相对的另一面焊接铜导线后,用环氧树脂密封,制成电极。工作面分别用400#,600#,800#,1000#,1500#以及3000#的SiC砂纸逐级湿磨,打磨好后用无水乙醇超声清洗10 min后用N2吹干,放入玻璃干燥器中备用。实验中所有溶液均采用分析纯试剂和电阻率为18.2 MΩ·cm的超纯水配制。北山地下水中主要阳离子为Ca2+、Na+、K+和Mg2+,阴离子为Cl-、
使用CHI 604E电化学工作站分别测试T2铜合金和Q235钢的开路电位(OCP),在三电极体系,其中参比电极为饱和Ag/AgCl电极(0.198 V vs. SHE),对电极为1 cm × 1 cm的Pt电极,测试时间持续1 h。极化曲线和电偶腐蚀实验使用内置有零电阻电流计(ZRA)的Ivium-n-Stat多通道电化学工作站进行测试。进行极化曲线测试时扫描速率为10 mV·min-1,扫描范围为OCP ± 300 mV。电偶腐蚀实验中,Q235钢为工作电极,T2铜合金为对电极,参比电极为饱和Ag/AgCl电极,实验中始终保持工作电极和对电极的距离约为1 cm。组装好的电解池固定好后放入恒温箱中保持温度为25或50℃,实验开始前,用气泵向溶液中通空气3 h以保持有氧状态,并持续通气至测试结束,待电偶电流和电偶电压稳定后,记录最后10 h数据取平均值。实验结束后,将需要进行表面分析的Q235钢电极小心取出,用超纯水清洗表面(不破坏腐蚀产物),无水乙醇脱水、N2吹干后暂放于手套箱中。
使用Regulus 8100场发射扫描电子显微镜(SEM)对Q235钢表面进行腐蚀产物形貌表征,LabRAM HR Evolution拉曼光谱仪(Raman,激发波长633 nm,扫描范围为100~2000 cm-1)进行腐蚀产物组成分析,DDS-11A电导率仪对溶液的电导率进行测试。
2 结果与讨论
2.1 OCP测试
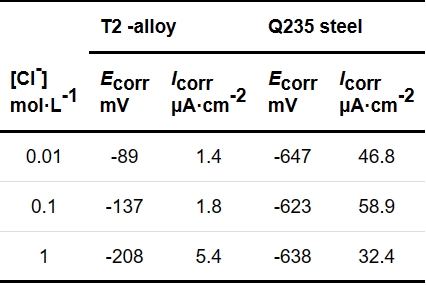
图1
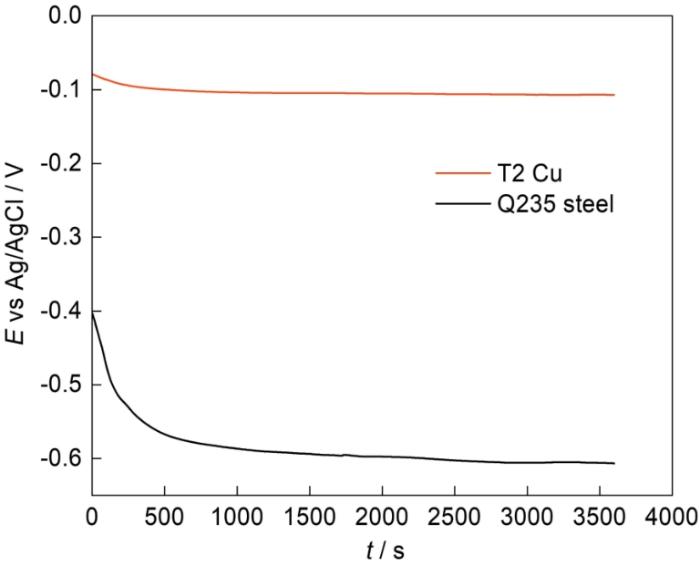
图1 T2铜合金和Q235钢在北山地下水模拟液中的OCP-t曲线
Fig.1 OCP-t curves of T2 Cu-based alloy and Q235 steel in simplified Beishan groundwater simulation fluid
25℃时Cl-浓度变化对T2铜合金和Q235钢OCP的影响如图2所示。Cl-浓度从0.001 mol·L-1增大到2 mol·L-1,T2铜合金的OCP整体出现明显的负移,负移值为230 mV;Q235钢的OCP先负移,后在0.05 mol·L-1到0.1 mol·L-1之间出现波动,最后在2 mol·L-1时又正移到-0.56 V,与在0.001 mol·L-1时数值几乎相同。可以看出,随着Cl-浓度增大,在一定浓度范围内,T2铜合金和Q235钢的OCP均出现了明显的负移,表明Cl-浓度从0.001 mol L-1增大到0.05 mol·L-1时,铜合金和碳钢的腐蚀倾向均增加。当Cl-浓度继续增大时,T2铜合金的OCP在0.05 mol·L-1后出现小幅正移后又继续大幅负移,表明T2铜合金在Cl-浓度较大时腐蚀倾向也在增加;而Q235钢的OCP在0.1 mol·L-1到1 mol·L-1出现小幅度负移,在1 mol·L-1之后出现明显的正移,表明Q235钢的腐蚀倾向在1 mol·L-1之后减小。T2铜合金和Q235钢OCP之间的差值在Cl-浓度大于0.1 mol·L-1时逐渐减小,表明它们之间的耦合效应可能在Cl-浓度较大时逐渐减弱。
图2
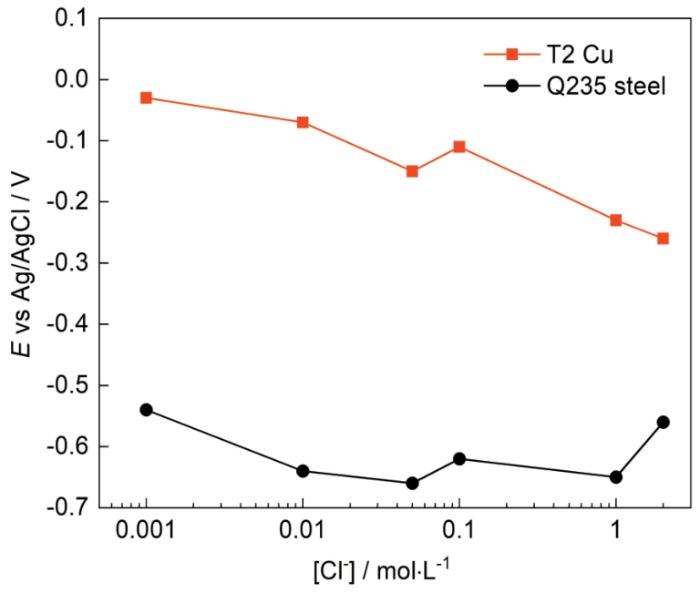
图2 25℃时Cl-浓度对T2铜合金和Q235钢OCP的影响
Fig.2 Influences of Cl- concentration on OCP values of T2 Cu-based alloy and Q235 steel at 25oC
2.2 极化曲线测试
为进一步探究Cl-浓度变化对T2铜合金和Q235钢腐蚀行为的影响,分别在0.01、0.1、1 mol·L-1溶液中对T2铜合金和Q235钢进行极化曲线测试,测试结果如图3所示,表1为极化曲线拟合结果。如图3a所示,T2铜合金的阴极极化受氧扩散控制,阳极极化表现为金属的活性溶解;在Cl-浓度为0.01和1 mol·L-1时,T2铜合金的阳极极化分支出现钝化现象,是由于在Cl-浓度较大时,铜合金表面形成了比较致密的钝化膜,使得电流密度出现了短暂的下降;随后钝化膜被击穿,电流密度继续升高。T2铜合金的腐蚀电位Ecorr随Cl-浓度增大出现负移,与OCP的结果相对应;腐蚀电流密度Icorr随Cl-浓度增大而增大,表明Cl-浓度增大会使T2铜合金的腐蚀速率加快。在图3b中,Q235钢的阴极极化明显也受氧扩散控制,阳极极化均表现为金属的活性溶解,没有出现钝化现象。Ecorr先正移后有所负移,Icorr先增大后减小,表明随Cl-浓度增大,Q235钢的腐蚀速率先增大后减小,过高的Cl-浓度会抑制Q235钢的腐蚀。从表1数据可以看出,在相同的溶液中,T2铜合金的腐蚀速率会明显低于Q235钢。因此对于“镀铜钢”金属储罐,在铜镀层未发生破损前,具有比碳钢更好的耐蚀性,可以有效延长金属储罐的使用寿命。
图3
图3 T2铜合金和Q235钢在25℃含不同Cl-浓度的溶液中的极化曲线
Fig.3 Polarization curves of T2 Cu-based alloy (a) and Q235 steel (b) in test solutions with different Cl- concentrations at 25oC
表1 T2铜合金和Q235钢的极化曲线拟合参数
Table 1
2.3 电偶腐蚀实验
一旦铜镀层发生破损并裸漏出碳钢基体,可能会导致碳钢基体发生严重的腐蚀。在镀铜钢材料中,铜镀层直接与钢基体接触,无法直接测试电偶电压和电偶电流[20],且在实验中如果铜镀层出现进一步破损,则电偶对的面积比将发生变化,影响实验结果的准确性。因此,本研究中将金属材料T2铜合金和Q235钢分别做成电极进行实验,且实验中始终保持铜电极和碳钢电极之间的距离为1 cm。不同Cl-浓度下T2铜合金和Q235钢耦合后碳钢表面的电偶电流密度(Ig,电偶电流与碳钢表面积的比值)和耦合后的电偶电压(Eg)如图4和图5所示。除了Cl-浓度外,还研究了温度和铜合金/碳钢面积比对电偶腐蚀的影响。实验在数据稳定至少10 h后停止测试,每个实验时间为2~5 d。如图4a,电偶对面积比为200∶1时的Ig明显大于电偶对面积比为10∶1时的Ig,说明电偶腐蚀速率与铜合金的面积有关,受阴极反应控制。在T2铜合金和Q235钢组成的电偶对中,T2铜合金表面主要发生O2的还原反应,Q235钢作为阳极主要发生Fe的氧化。因此,在电偶腐蚀中,O2在铜合金表面的还原反应为速度控制步骤。面积比增大时,更多O2可以在铜合金表面还原,阴极电流增加,在电偶腐蚀中阴极阳极电流保持相等,所以当阳极面积相对较小时,Ig增大。
图4
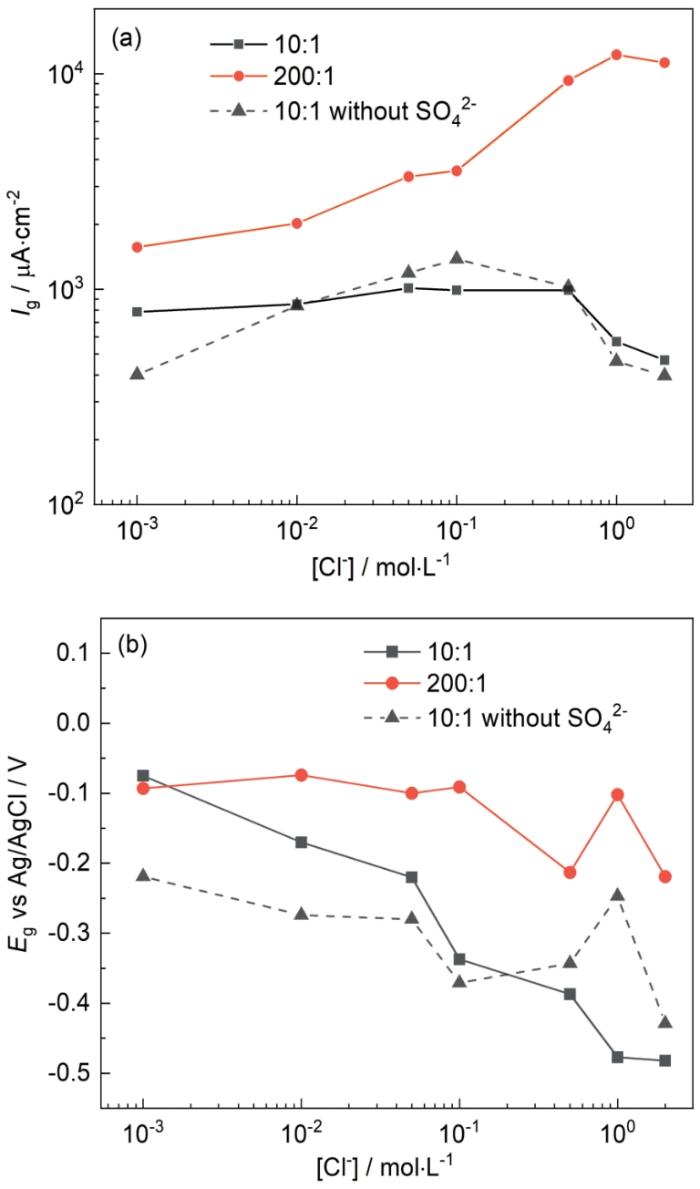
图4 25℃时Cl-浓度对碳钢表面电偶电流密度和电偶电压的影响
Fig.4 Influences of Cl- concentration on galvanic current density (a) and galvanic potential (b) of Q235 steel at 25oC
图5
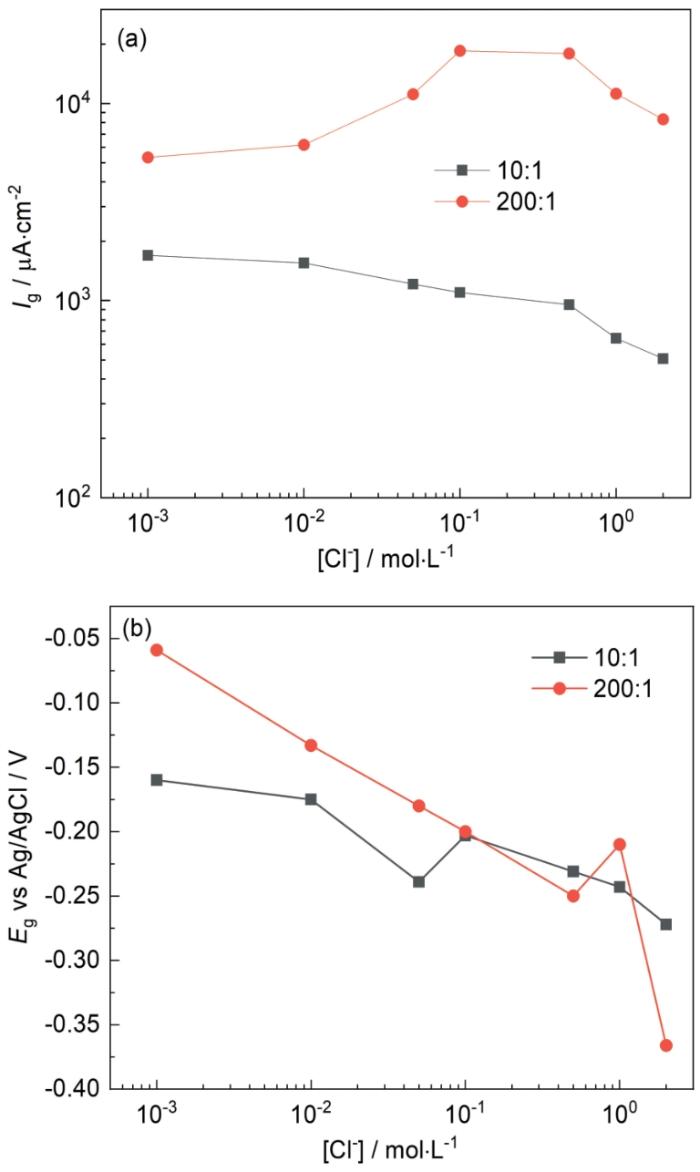
图5 50℃时Cl-浓度对碳钢表面的电偶电流密度和电偶电压的影响
Fig.5 Influences of Cl- concentration on galvanic current density (a) and galvanic potential (b) of Q235 steel at 50oC
在溶液中随着Cl-浓度增大,溶液中O2的溶解度降低。有文献指出在22℃时,O2在0.1 mol·L-1 NaCl溶液中的溶解度为在3 mol·L-1 NaCl溶液中的2.7倍[23];在25℃时,O2在1 mol·L-1 NaCl溶液中的溶解度为在2 mol·L-1 NaCl溶液中的1.4倍,且O2溶解度降低的速率随Cl-浓度增大变缓[24],溶解O2的降低会导致溶液中的氧浓度梯度下降,减少O2到铜合金表面的扩散通量,影响O2在铜合金表面的还原速率,进而降低电偶腐蚀速率。有文献也指出NaCl溶液中随Cl-浓度增大,O2的扩散系数会减小[25],进而降低O2到铜合金表面的扩散通量。其次,Cl-浓度变化还会影响溶液的电导率,如图6所示,在25℃,溶液中含有0.015 mol·L-1 Na2SO4,Cl-浓度为0.01、0.1和1 mol·L-1时,溶液电导率分别为2540、6900、42600 μS·cm-1,溶液电导率随Cl-浓度增大而增加,电导率的增加使溶液电阻下降,同时也加速了金属表面钝化膜的破裂,加快阳极溶解过程,导致电偶腐蚀速率加快。因此,在溶解氧和溶液电导率的相互影响下,Ig不会随着Cl-浓度的增大持续增大,而是存在最大值。Eg的负移可能与溶液中溶解氧的减少有关,且Eg值更靠近T2铜合金的Ecorr,这也表明了在电偶腐蚀中反应受阴极的控制。
图6
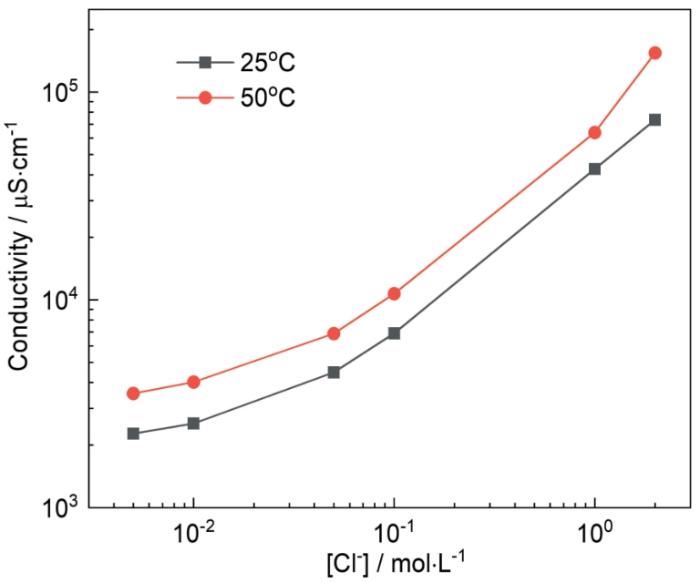
图6 不同温度下实验溶液电导率随Cl-浓度的变化
Fig.6 Variations of electrical conductivity of the test solution with Cl- concentration at 25oC and 50oC
Standish等[20]研究表明,当铜合金和碳钢的面积比为10∶1时,Ig 在Cl-浓度为0.01~0.1 mol·L-1时出现最大值,这与本文的结果基本对应。但是当溶液中加入0.015 mol·L-1 Na2SO4,电偶对面积为10∶1时,Ig 随Cl-浓度增大变化不明显,这表明
50℃时Cl-浓度对Ig的影响如图5a所示。面积比为10∶1时,Ig的数值均大于25℃时测得的数值,且Ig的最大值出现在Cl-浓度为0.001 mol·L-1时,随Cl-浓度增大,Ig逐渐降低,在2 mol·L-1时两个温度下的Ig值仅相差39.6 μA·cm-2;面积比为200∶1时,Ig值在Cl-浓度低于0.5 mol·L-1时高于25℃时测得的数值,随后Ig迅速减小最后在2 mol·L-1时为9309.2 μA cm-2,低于25℃时的11257.8 μA·cm-2。在图5b中,Eg随Cl-浓度增大负移,变化趋势与25℃时相同。由图5结果可以看出,温度升高,会使Ig增大,即电偶腐蚀速率加快,这是因为温度升高时,相同Cl-浓度下溶液电导率也随之增大(图6)。但温度的升高也会引起溶液中溶解O2的减少,在常压下,20℃时O2在纯水中的溶解度约为50℃时的1.5倍,30℃时O2在1 mol·L-1 NaCl溶液中的溶解度约为60℃时的1.6倍[26],且随着Cl-浓度增大,溶液中的溶解O2也会减少,因此在50℃时,Ig出现最大值时的Cl-浓度更低。
2.4 腐蚀产物分析
图7为在25℃、面积比为10∶1时,Q235钢在Cl-浓度分别为0.001、0.05和2 mol·L-1溶液中进行电偶腐蚀48 h后的SEM形貌图。不同Cl-浓度下腐蚀形貌基本一致,腐蚀产物均匀分布在碳钢表面,可分为内、外两层,内层腐蚀产物较致密,外层腐蚀产物呈絮状。其中,Cl-浓度为0.05 mol·L-1时(图7c和d),碳钢表面外层絮状腐蚀产物最多,且聚集在一起;而Cl-浓度为0.001 mol·L-1(图7a和b)和2 mol·L-1(图7e和f)时,外层絮状腐蚀产物减少,且没有出现聚集。图7中的腐蚀产物表面出现裂痕是因为在进行脱水干燥时腐蚀产物表面破裂所致。SEM形貌图所示的表面腐蚀情况表明了在Cl-浓度为中等浓度时,腐蚀最严重,这与电偶腐蚀电化学测试结果相对应。
图7
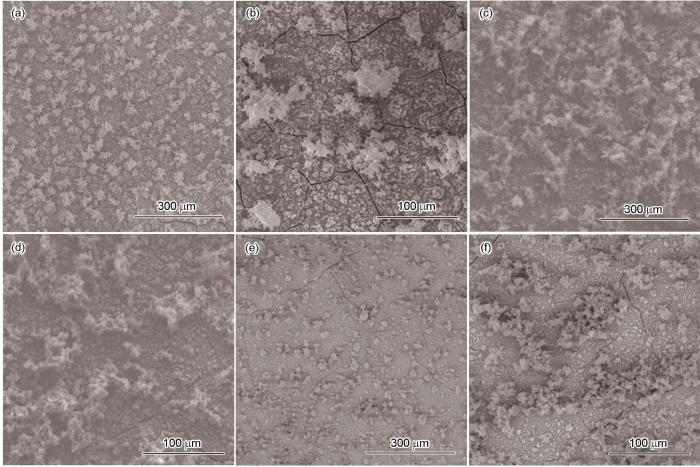
图7 25℃时不同Cl-浓度下面积比为10∶1时Q235钢表面腐蚀后SEM形貌图
Fig.7 SEM surface morphologies of Q235 steel after corrosion at 25oC under the conditions of the area ratio of 10∶1 and Cl- concentrations of 0.001 mol·L-1 (a, b), 0.05 mol·L-1 (c, d), and 2 mol·L-1 (e, f)
图8为Q235钢在25℃下面积比为10∶1以及Cl-浓度为0.05 mol·L-1条件下溶液中电偶腐蚀48 h后的表面Raman光谱测试结果,分别对内层和外层进行测试。如图8a和b所示,内层腐蚀产物在257 cm-1检测到明显的纤铁矿γ-FeOOH[27]的特征Raman峰,在307、387 cm-1处检测到明显的针铁矿α-FeOOH[28,29]的特征Raman峰,在1318 cm-1处检测到少量α-Fe2O3[30]的特征峰;在535 cm-1处可见磁铁矿Fe3O4[30]的特征Raman峰;在外层,如图8c,d所示,腐蚀产物主要为α-Fe2O3[31],其特征Raman峰位于231、297、412、500、612和1324 cm-1处,此外还有α-FeOOH和少量位于670 cm-1处的Fe3O4特征Raman峰。在Raman测试的结果中并未发现Fe的氯化物的特征Raman峰,可能因为Cl-浓度较低和测试时间较短,Fe的氯化物没有在碳钢表面沉积,也有研究表明Cl-在溶液中可以通过促进阳极溶解来加速腐蚀,生成的FeCl2不稳定容易被氧化成FeOOH,Cl-又重新释放回溶液中[32],在这个过程中Cl-起到某种催化剂的作用。从Raman测试结果可以看出,在电偶腐蚀中,阳极发生溶解后会先生成γ-FeOOH,由于γ-FeOOH不稳定,容易被转化成比较稳定的α-FeOOH,当腐蚀产物暴露在空气中时生成更稳定的α-Fe2O3;而当腐蚀产物形成后内层由于氧气减少,FeOOH会部分转化成Fe3O4,腐蚀产物会减缓碳钢基体的腐蚀速率,因此在进行电偶腐蚀测试时总是观察到Ig随测试时间的进行逐渐变小直至稳定。
图8
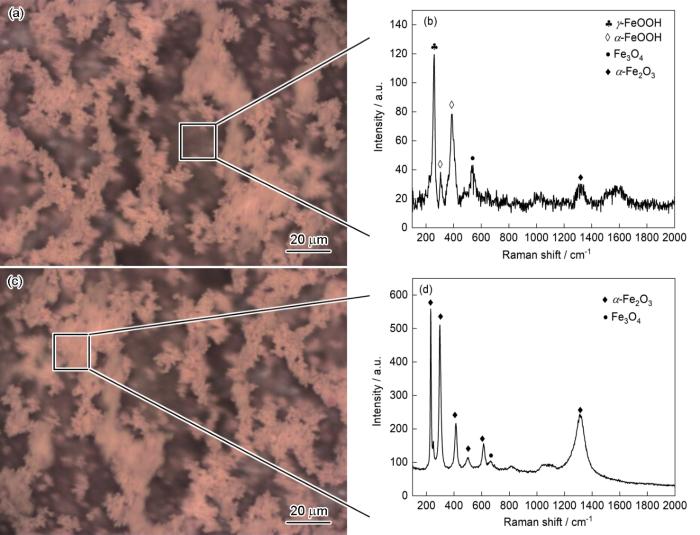
图8 Q235钢在25℃下面积比为10∶1以及Cl-浓度为0.05 mol·L-1条件下溶液中电偶腐蚀48 h后的表面Raman光谱
Fig.8 Raman spectra of inner layer (a, b) and out layer (c, d) of corrosion products formed on Q235 steel after galvanic corrosion, at 25oC with [Cl-] = 0.05 mol·L-1, Cu/carbon steel area ratio = 10∶1
3 结论
(1) OCP测试结果表明,在简化版北山地下水模拟液中T2铜合金和Q235钢接触会发生严重电偶腐蚀,T2铜合金为阴极受到保护,Q235钢为阳极腐蚀速率加速;随Cl-浓度增大OCP差值减小,耦合效应可能减弱。
(2) 极化曲线测试结果表明,T2铜合金和Q235钢阴极极化均受氧扩散控制,阳极极化为金属的活性溶解,随Cl-浓度增大T2铜合金阳极极化存在钝化现象;T2铜合金的自腐蚀速率远低于Q235钢,铜镀层良好的耐蚀性可以有效延长金属储罐的使用寿命。
(3) 电偶腐蚀实验表明,T2铜合金和Q235钢之间发生的电偶腐蚀受阴极O2的还原反应控制;随Cl-浓度增大,溶液中溶解O2含量降低、氧扩散系数减小、电导率升高等因素使得Ig存在最大值,且温度升高时,Ig在Cl-浓度更低时出现最大值,因此,在处置库关闭初期的有氧高温环境中,具有中等Cl-浓度的北山地下水模拟液对T2铜合金和Q235钢的电偶腐蚀危害较大。
(4) 腐蚀产物分析结果表明,Q235钢表面腐蚀产物分为较致密的内层和成絮状的外层,主要为Fe的羟基氧化物/氧化物。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414