盐酸左氧氟沙星(LEV)作为氟喹诺酮类(FQS)药物中应用最广的一类抗生素,由于其在动物体内的代谢效率较低,很容易随着代谢物进入水环境中,因此对生态环境以及人类健康生活产生了极大威胁。目前,人们已经采取了多种方法从水体中去除LEV[1-6]。在众多的处理方法中,吸附法因其具有操作简单,处理成本低,绿色环保等优势,被认为是一种极具潜力的抗生素处理方法[7]。而今已有多种吸附材料被开发并用于LEV的去除[8-10]。然而,这些吸附材料往往存在制备成本高、降解程度低、易造成二次污染、不易回收等问题,限制了其广泛应用[11-14]。因此,需要开发合适的吸附材料来去除水体中的LEV。
生物质气凝胶是一种三维多孔固体网状轻质材料,具有低密度、大比表面积、高孔隙率、简单易得、易降解、无污染等优点[15]。目前已经作为吸附材料,被用于水体中抗生素污染物的处理。例如,Li等[16]设计并制备了一种由木质素(LN)、蒙脱土(MMT)和纤维素组成的生物质复合气凝胶LN/MMT @cellulose,能够有效吸附水中的环丙沙星、四环素和甲氧苄啶污染物。
明胶(Gel)是一类非常重要的天然生物高分子材料,自身无毒并且其分子结构中含有大量的—OH,—NH2,—COOH等官能团[17],这使得明胶易于凝胶化和功能化,因此,Gel很适合用来制备生物质气凝胶[18]。然而,Gel的稳定性低、机械阻力小,常常需要加入骨架增强材料,帮助其成型。氧化石墨烯(GO)是一种具有高比表面积和丰富含氧官能团的二维碳材料[19],能够对气凝胶内部交联结构起到支撑作用。如Kovtun等[20]分别选用嵌入和包覆的方法,制备了两种类型的氧化石墨烯-壳聚糖-明胶复合气凝胶,结果显示,两种复合气凝胶对氧氟沙星和环丙沙星都表现出了较好吸附性能。然而,GO由于自身的高内聚力,使得其在溶液中分散性较差,阻碍了GO的潜在应用。因此,需要通过对GO进行化学改性以改善其性能[21]。
十二烷基二甲基苄基氯化铵(BKC)是应用最为广泛的季铵盐类阳离子表面活性剂之一[22-23],其结构中包含了完整的苯环结构以及亲水性的氯化铵结构,能够通过π-π相互作用以及静电相互作用组装在GO表面,对其进行非共价改性[24],促进GO片层进一步分离,并改善其分散性。聚多巴胺(PDA)是一种环保型生物高分子聚合物[25],在碱性条件下能够在底物上形成黏附膜,帮助被包覆的底物更好地与骨架材料结合,有利于底物成为后续功能化材料的良好中间体。
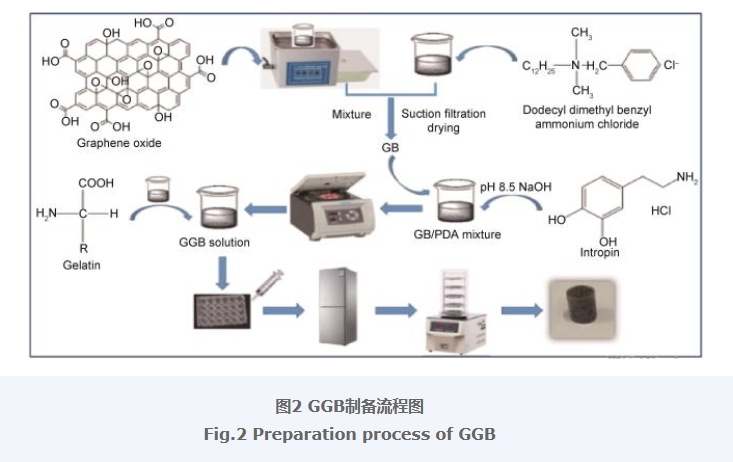
基于此,本工作利用BKC对GO进行改性,选择PDA进行包覆,并进一步与Gel进行复合,采用溶胶-凝胶法结合冷冻干燥技术制备了明胶/改性氧化石墨烯/聚多巴胺复合气凝胶(GGB),探究了复合气凝胶对LEV的吸附行为,并分析了吸附机理,为改性GO复合气凝胶吸附抗生素提供借鉴。
1 实验材料与方法
1.1 实验材料
氧化石墨烯(GO)购自苏州碳丰科技有限公司,明胶(Gel)购自上海阿拉丁生化科技股份有限公司,盐酸多巴胺(DA)和十二烷基二甲基苄基氯化铵(BKC)购自润有化学有限公司,盐酸左氧氟沙星(LEV)购自天津大茂化学试剂厂,盐酸(HCl,37%)购自常州武卫试剂厂,氢氧化钠(NaOH)购自天津北联精细化学品开发有限公司。实验过程中所用到的水均为去离子水。
1.2 实验方法
1.2.1 BKC改性GO的制备
对GO进行改性[26],具体改性方法如下:将0.04 g GO置于30 mL去离子水中超声分散30 min得到GO分散液;再称取0.08 g BKC置于30 mL去离子水中,在室温条件下搅拌30 min,令其完全溶解;将GO分散液与BKC溶液混合,在25 ℃下搅拌2 h后抽滤,去离子水洗涤数次,在60 ℃的烘箱中烘干,得到BKC改性的GO粉末,记作GB。
1.2.2 明胶/改性氧化石墨烯/聚多巴胺复合气凝胶(GGB)的制备
首先称取上述制备的GB粉末0.04 g并置于10 mL去离子水中,再称取0.5 g DA,并在DA粉末中加入10 mL pH值为8.5的NaOH溶液,搅拌至完全溶解。之后,将上述GB溶液与DA溶液混合,待反应完全后离心分离,得到PDA包覆GB的复合材料GBP。将GBP再分散到10 mL去离子水中,随后将GBP与Gel溶液进行混合,在40 ℃下继续搅拌1 h。最后,装入孔板中静置老化,在冰箱预冻24 h,再由冷冻干燥机(FD-1A-50)连续冷冻干燥12 h后,得到Gel/GB/PDA复合气凝胶,并命名为GGB,其外观如图1所示,整个GGB制备流程如图2所示。为进行相应的对比,参照上述实验步骤,以未改性GO为原料,制备出Gel/GO/PDA复合气凝胶,命名为GGO。
准确配制体积为50 mL、浓度为150 mg/L的LEV溶液,用0.1 mol/L HCl和0.1 mol/L NaOH调节LEV溶液的pH值,然后向调节好pH值的LEV溶液中加入复合气凝胶GGB,并将其置于数显全温振荡器(HZQ-1)中,25 ℃振荡吸附,待吸附平衡后,移取少量LEV溶液,利用紫外可见分光光度计在294 nm处测得LEV溶液的吸光度,并通过标准曲线法计算吸附平衡后LEV溶液的浓度,进而计算复合气凝胶GGB对LEV的吸附量和去除率。
吸附量计算公式:
2 结果与分析
2.1 复合气凝胶的形貌和结构表征
利用SEM(Gemini500)对制备出的两种复合气凝胶进行形貌表征,图3为GGO,GGB的扫描电镜图以及GGB的EDS能谱图。图3(a),(b)分别为GGO的表面和截面图,从图3(a)中可以看到,GGO表面较为光滑,存在一些褶皱和少量细小的孔洞,整体呈现出了致密的结构,而从图3(b)中也可以看出,GGO内部的结构和表面类似,同样呈现出致密紧实的结构,并且GGO内部孔洞数量更为丰富,同时出现一些沟壑。图3(c),(d)分别为GGB的表面和截面图,从图3(c)中可以看出,GGB的表面存在大量孔洞,呈蜂窝状不规则排布,孔壁之间相互交联错落有致,孔道明显。与GGO表面孔洞相比,GGB表面孔洞的孔径明显增大。这表明改性后的GO片层被进一步剥离,增大了其片层间距,并改善了GO分散性,避免了团聚的发生,使其能够更好地作用于Gel网络结构中进行支撑。从图3(d)中同样可以看出,GGB内部孔道丰富,材料整体呈现三维网状多孔结构。从图3(e)~(h)GGB的EDS能谱图中可以看到,C,O,N,Cl元素在复合气凝胶上均匀分布,说明GO被BKC成功改性,同时也表明复合气凝胶GGB制备成功。
2.2 化学结构分析
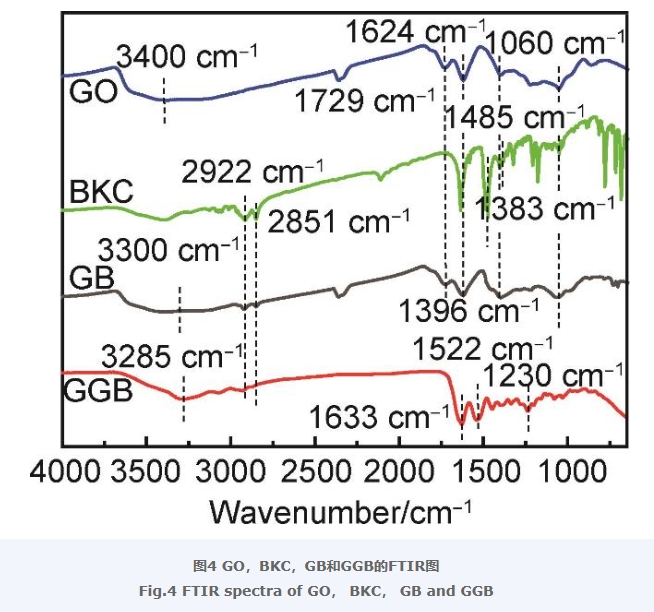
图4为GO,BKC,GB以及GGB的傅里叶变换红外光谱(FTIR,IR-21)。从图中可以看出,GO在3400 cm-1处有一个明显宽峰,属于—OH的伸缩振动,除此之外,在1729,1624,1396,1060 cm-1的特征吸收峰分别属于C=O,C=C,C—OH和C—O—C的伸缩振动,它们归属于GO中的各种含氧基团的特征吸收[27-28]。BKC在2922,2851 cm-1的特征吸收峰属于典型的—CH3,—CH2—的伸缩振动,1485,1383 cm-1处的特征吸收峰归属于C—N键的伸缩振动[29-30]。在GB的红外光谱中,—OH的伸缩振动出现在了3300 cm-1,吸收峰向低波数方向发生移动,这表明GO与BKC之间存在着氢键相互作用,这种作用使得电子云密度发生平均化,从而影响伸缩振动的频率。此外,在2922,2851 cm-1处同样出现了—CH3,—CH2—的伸缩振动,并且GO中的各含氧基团的特征吸收峰也能够在GB的红外光谱中找到相应归属,证明GO已经成功被BKC改性。GGB的红外图谱在3285 cm-1明显可以看出N—H伸缩振动,2922,2851 cm-1出现了明显的—CH3,—CH2—伸缩振动,1633,1522 cm-1处的吸收峰属于C=O和C=C的伸缩振动,1230 cm-1处的特征吸收峰归因于N—H的弯曲振动[31],上述特征峰的出现,证实了复合气凝胶GGB制备成功。
2.3 复合气凝胶的元素组成分析
图5是GGB吸附LEV前后的XPS(Thermo Scientific K-Alpha)全谱图以及C,O,N,Cl,F各元素的高分辨率XPS光谱图。从图5(a)和图5(f)中可以看出GGB吸附LEV后的XPS全谱图上新出现了F1s的特征峰,且图5(f)中F元素的出现证实了LEV已经被GGB成功吸附[32]。图5(b)C1s XPS 谱图中包含了C—C/C=C,C—O/C—N,C=O/C=N键,C—C/C=C的相对含量由GGB吸附LEV前的43.11%增加到吸附LEV后的77.46%,表明GGB与LEV之间存在着明显的π-π相互作用。而C—O/C—N的相对含量也有由吸附LEV前的35.99%降低到吸附LEV后的13.11%,这可能是由于GGB与LEV之间发生的氢键相互作用。此外,从图5(c)N1s可以看到,GGB吸附LEV后—N—的相对含量略有增加,也证明LEV的成功吸附,同时—N+的相对含量从吸附LEV前的2.02%降低到了吸附LEV后的1.86%,说明GGB与LEV之间存在着弱的静电相互作用,类似的结论从图5(d)O1s也可以得到。吸附前后Cl2p的变化如图5(e)所示,结合能的变化表明了氯原子与羧基之间存在静电相互作用。以上分析表明LEV主要通过π-π相互作用、氢键相互作用和静电相互作用与GGB发生吸附。
2.4 接触时间对吸附性能的影响
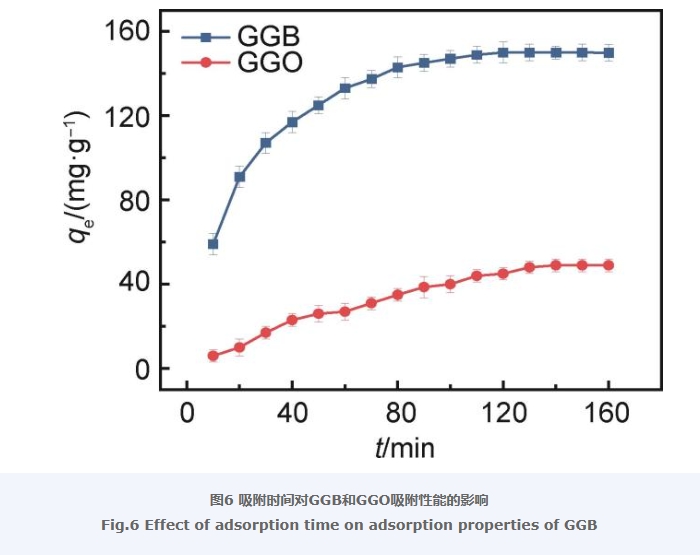
图6为GGB和GGO在298 K下对抗生素LEV的吸附量与吸附时间的关系。从图6中可以看出,GGB和GGO对于LEV的吸附平衡时间相差不大,都在120 min左右,但GGB对LEV的平衡吸附量明显优于GGO,GGO对LEV的平衡吸附量只有49 mg/g,而GGB对LEV的平衡吸附量达到了150 mg/g,是GGO对LEV平衡吸附量的3倍有余。上述结果表明,经过BKC改性后的GO与Gel复合制备得到的气凝胶能够有效提升其对于LEV的吸附能力。此外,从图6中也可以看出,GGB吸附LEV的前50 min吸附速率较快,而后续的50~110 min吸附速率变得缓慢,在120 min达到吸附平衡。而GGO吸附LEV基本保持匀速进行,在0~120 min的吸附过程中吸附速率变化不大。结合形貌的差别,分析原因可能是由于BKC通过静电作用和π-π作用组装在GO表面,有效阻止了GO片层之间的紧密的π堆叠,促进GO片层和Gel构成具有多孔结构的GGB,其表面大量的孔道,有助于对LEV吸附容量的提升。而GGO表面较为致密紧实,存在少量的空洞,使得其对于LEV吸附容量相对较差。
2.5 pH值对吸附性能的影响
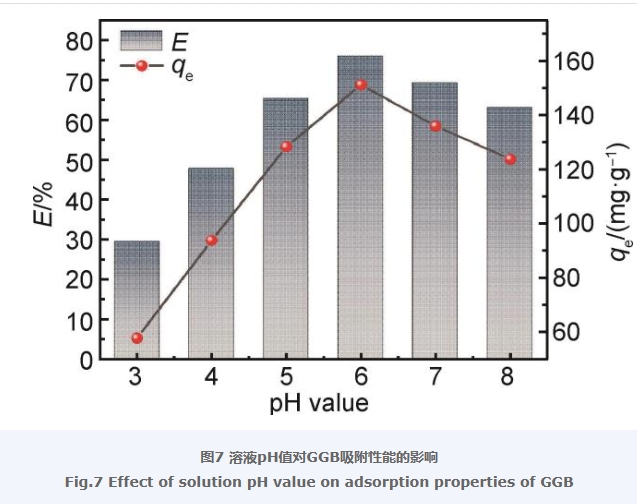
溶液的pH值对吸附具有重要影响,因为它能够调控吸附剂与吸附质的表面电荷,从而影响二者之间的相互作用。溶液pH值对GGB吸附性能的影响如图7所示。由图7可以看出,在pH值从3增加到8的过程中,GGB对LEV的去除率和吸附量呈现先增加后减少的趋势,当pH值为6时,GGB对LEV的去除率达到75.75%,为最佳条件,其平衡吸附量为150.80 mg/g。这可能是由于在pH值较低时,溶液中H+浓度较高,GGB表面的羟基、氨基等官能团受溶液中大量H+的影响,发生质子化,使GGB表面显正电性,同时,在酸性条件下,LEV分子中叔胺基同样被质子化,以阳离子形式存在的LEV与GGB的电性相同,两者相互排斥,使得吸附量不高;随着pH值继续增加,H+浓度逐渐减小,GGB表面的相关官能团质子化作用降低,同时LEV分子中的叔胺基官能团,其质子化程度也同样降低,LEV与GGB之间的电性相斥作用减弱,吸附量增加。此外,羟基、氨基等官能团由于受质子化作用的影响,也会减弱GGB与LEV分子之间氢键相互作用的发生,从而影响吸附量。当溶液pH值为6时,GGB与LEV分子静电相斥作用最弱,吸附量达到最大值。随着pH值的继续增加,GGB结构中的羧基发生去质子化,GGB逐渐转为负电性,同时LEV分子上的羧基也同样电离出H+,GGB与LEV之间的静电相斥作用又被增强,使得GGB对于LEV的吸附量降低。虽然GGB在pH值为7和8时,对于LEV的吸附量有所降低,但仍保持了一定的吸附能力,这也说明了GGB对LEV的吸附作用除了静电作用外,还有π-π堆积作用、氢键作用等其他因素。综合以上结果,后续实验选定在上述最优pH值为6条件下进行。
2.6 初始溶液浓度对吸附性能的影响
在其他参数不变的情况下,LEV初始液浓度对GGB吸附性能的影响如图8所示。从图8中可以看出,随着LEV的初始浓度由100 mg/L逐步增加到300 mg/L,去除率从76.26%逐步下降到65.83%,而平衡吸附量从101.21 mg/g上升到262.14 mg/g。这是因为在GGB投加量保持不变的情况下,随着溶液中LEV浓度的逐渐增大,吸附剂吸附LEV的量也随之增加,但是因其吸附容量有限,使得过多的LEV无法与气凝胶发生吸附,造成去除率下降。综合考虑,选择LEV溶液初始浓度为150 mg/L进行后续实验,此浓度下的去除率为75.75%,平衡吸附量为150.80 mg/g。
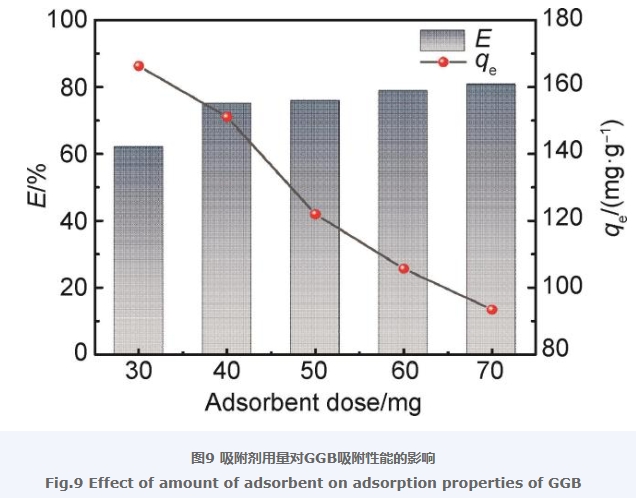
2.7 吸附剂用量对吸附性能的影响
GGB用量对其吸附LEV性能的影响如图9所示。从图9中可以看出,吸附剂用量从30 mg增加到70 mg,GGB对LEV的去除率从61.91% 增加到了80.53%,但平衡吸附量从165.90 mg/g减少到了93.40 mg/g,这是由于随着吸附剂用量的增多,与LEV接触的位点也同样增多,从而得到较高的去除率,但随着吸附剂用量的增多,单位质量下的吸附剂上吸附LEV的量减少,使得平衡吸附量下降。因此综合考虑,选择40 mg的吸附剂投加量来进行后续的实验。
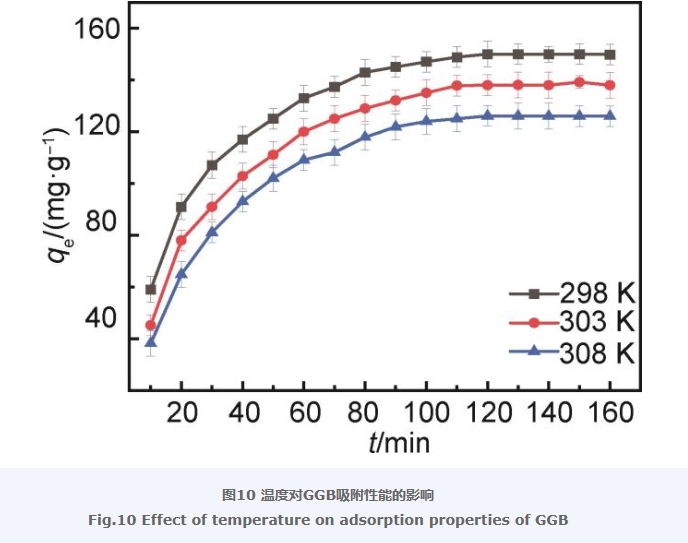
2.8 温度对吸附性能的影响
图10显示的是GGB在温度分别为298,303,308 K时对LEV的吸附情况。由图10可以看到,在298 K时GGB对LEV的平衡吸附量最大,达到了150 mg/g,并且随着温度逐渐升高至308 K,GGB对LEV的平衡吸附量从150 mg/g逐步降低至125 mg/g。结果表明,随着温度的升高,GGB对LEV的吸附量逐渐降低,并且吸附速率未发生明显变化。
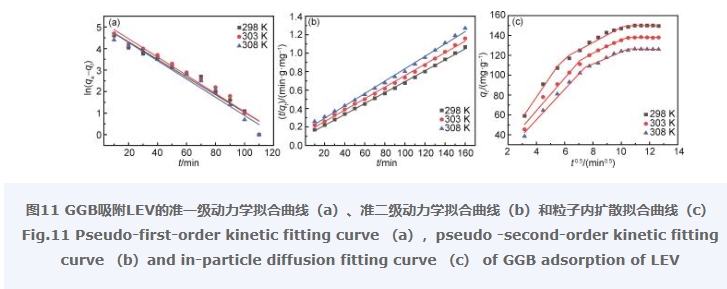
2.9 吸附动力学实验研究
式中: Ki 是速率常数,mg/(g·min0.5); ci 是边界层厚度。
图11为GGB对LEV吸附动力学拟合曲线,拟合得到对应模型的参数记录于表1和表2。从表1数据可以看出,准二级动力学模型拟合得到的线性相关系数R 2(0.99)优于准一级动力学模型拟合得到的线性相关系数R 2(0.95~0.96),且准二级动力学模型拟合得到的平衡吸附量q e(298 K: 168.63 mg/g,303 K: 160.51 mg/g,308 K: 149.03 mg/g)数据与实验得到的平衡吸附量q e(150 mg/g)更为接近。这表明GGB对LEV的吸附过程更加符合准二级动力学模型,吸附主要受化学吸附控制。
表1 GGB对LEV的吸附动力学拟合参数Table 1 Fitting parameters of LEV adsorption kinetics of GGB |
| T/K | Pseudo-first-order kinetic model | Pseudo-second-order kinetic model | ||||
|---|---|---|---|---|---|---|
| q e/(mg·g-1) | k 1/min-1 | R 2 | q e/(mg·g-1) | k 2/min-1 | R 2 | |
| 298 | 169.01 | 0.0409 | 0.954 | 168.63 | 0.00593 | 0.998 |
| 303 | 200.33 | 0.0424 | 0.958 | 160.51 | 0.00623 | 0.996 |
| 308 | 169.18 | 0.0424 | 0.963 | 149.03 | 0.00671 | 0.995 |
表2 GGB对LEV的粒子内扩散模型拟合参数Table 2 Fitting parameters of GGB for LEV intra particle diffusion model |
| T/K | K 1/(mg·g-1·min-0.5) | R |
K 2/(mg·g-1·min-0.5) | R |
K 3/(mg·g-1·min-0.5) | R |
|---|---|---|---|---|---|---|
| 298 | 20.97 | 0.975 | 7.639 | 0.948 | 0.217 | 0.309 |
| 303 | 16.42 | 0.969 | 6.702 | 0.993 | 0.066 | 0.035 |
| 308 | 15.36 | 0.982 | 6.155 | 0.922 | 0.196 | 0.994 |
为进一步讨论其吸附速率,选用粒子内扩散模型进行拟合,结果如图11(c)所示,拟合参数见表2,从图11(c)和表2可以看出,GGB吸附LEV的过程大致可以分为三个阶段。第一阶段是边界层扩散阶段,曲线斜率较高,这是因为在吸附初期,气凝胶表面有大量的—COOH,—OH和—NH2,为LEV提供了丰富的活性吸附位点,使得LEV能够快速进入气凝胶表面;第二阶段是LEV扩散到吸附剂孔隙中的颗粒内扩散过程,拟合出的曲线没有经过原点,这表明GGB与LEV之间还存在其他吸附机制的影响;第三阶段是吸附与解吸平衡阶段,气凝胶的吸附位点被完全占据,吸附量趋于饱和。从粒子内扩散模型中可以看出,在整个吸附过程中,边界层扩散和颗粒内扩散过程为主要控速步骤,说明了GGB吸附LEV的过程主要由这二者来共同控制。
2.10 吸附热力学实验研究
利用范特霍夫方程对GGB吸附LEV的过程进行热力学研究。热力学函数焓变(ΔH)、吉布斯自由能(ΔG)、熵变(ΔS)可根据式(6 ),(7 )计算:
2.11 吸附等温实验研究
图12是GGB吸附LEV的Langmuir和Freundlich等温吸附拟合曲线,从图12和表4的拟合参数可以看出,当温度为298 K时,Langmuir等温吸附模型拟合的相关系数R 2=0.990高于Freundlich等温吸附模型拟合的相关性系数(R 2=0.965),此外,较低的R L值(0.460)也表明使用Langmuir等温吸附模型进行模拟是有利的。基于以上分析,GGB吸附LEV的过程属于单分子层吸附。通过Langmuir等温吸附模型计算出GGB在298 K的温度条件下对于LEV的理论最大吸附量能够达到476.42 mg/g。表5中列出了近年来报道的LEV吸附材料[34-38],从表5中的数据可以发现,和其他吸附剂材料相比,本研究所制备的吸附剂对LEV具有更大的吸附容量。
| Langmuir model | Freundlich model | |||||
|---|---|---|---|---|---|---|
| q m/(mg·g-1) | k L | R 2 | R L | k F | n | R 2 |
| 476.42 | 0.0117 | 0.990 | 0.460 | 16.87 | 1.689 | 0.965 |
表5 不同吸附剂材料对LEV的最大吸附量比较Table 5 Comparison of adsorption properties of different adsorbents for LEV |
| Adsorbent | T/K | pH value | C 0/(mg·L-1) | q m/(mg·g-1) | Reference |
|---|---|---|---|---|---|
|
2-hydroxypropyl-β-cyclodextrin/ poly(acrylic acid)/poly (vinyl alcohol) nanofibrous membrane |
318 | 100 | 110 | [34] | |
| Rice husk biomass materials | 318 | 7 | 120 | [35] | |
| Biochar-supported manganese dioxide composite | 298 | 7.7 | 50 | 104.13 | [36] |
| MWCNTs/CoFe2O4 nanocomposites | 303 | 5 | 50 | 122 | [37] |
| Pithophora macroalgae biosorbent | 298 | 6.5 | 150 | 17.8 | [38] |
| GGB | 298 | 6 | 150 | 476.42 | This study |
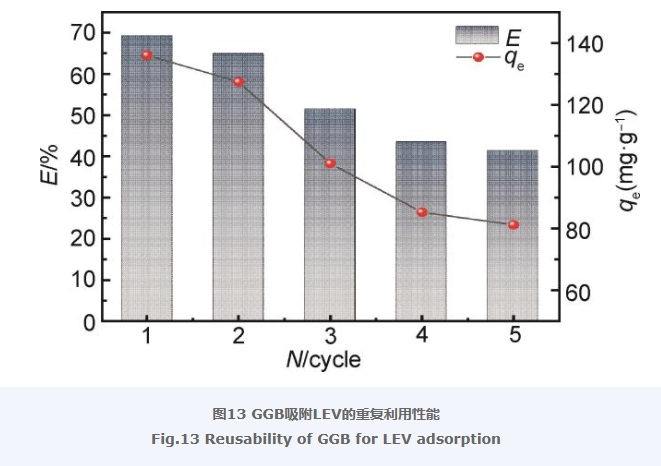
2.12 复合气凝胶吸附LEV的循环性能
图13显示了GGB吸附LEV的重复利用性能。由图13可知,当循环第一次时,LEV的去除率为69%,平衡吸附量为135.64 mg/g,之后每进行一次循环,LEV的去除率和平衡吸附量都相应地降低和减少,分析其中的原因可能是气凝胶存在着脱附不完全的问题,表面活性剂改性的GO体现出两亲的特性,使得脱附变得困难,脱附不完全,因此,随着循环次数的增多,GGB对LEV的吸附量也不断降低。此外,在脱附过程中,部分气凝胶的损失也会造成GGB对LEV吸附量的降低。从图13中也可以看出,经过5次循环后GGB对LEV的平衡吸附量仍超过80 mg/g,相比其他吸附LEV的材料,GGB对于LEV的吸附效果依然具有一定的优势[39]。
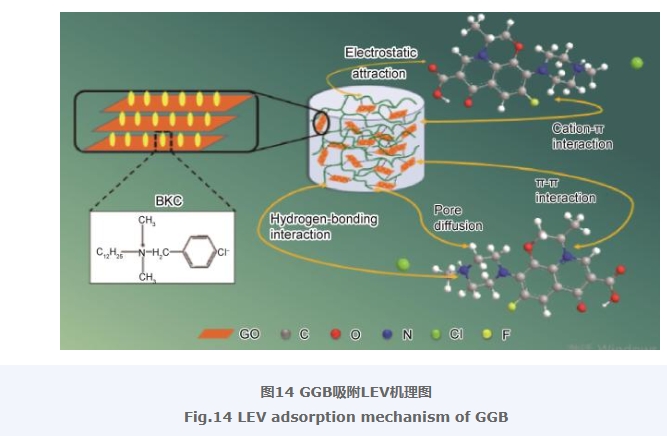
2.13 复合气凝胶吸附LEV的机理分析
通过实验结果推测了GGB吸附LEV的可能机理,如图14所示。首先,由GGB的SEM分析可以看出,复合气凝胶表现出优异的三维蜂窝状多孔结构。因此,孔隙扩散作用是GGB吸附LEV发生的主要物理作用。其次,由pH对GGB吸附LEV的分析可以得出,受复合气凝胶表面羟基、羧基、氨基等官能团的影响,LEV与GGB可以发生静电相互作用。此外,GGB表面羟基,氨基等也能够与LEV分子发生氢键相互作用,提升GGB对于LEV的吸附能力,相关的XPS分析也证明了氢键和静电作用的存在。再次,由于气凝胶体系中包含大量的π共轭结构(如GO的共轭结构、BKC的苯环结构、PDA的邻苯二酚共轭结构),毫无疑问能够与LEV结构中的芳香环形成有效的π-π相互作用。最后,阳离子-π键是一种较强的相互作用,可以发生在富电子的π体系和相邻的阳离子之间。GGB结构中的π电子可以与LEV结构中的质子化氨基形成阳离子-π键。综上所述,复合气凝胶可能是通过静电作用、氢键相互作用、π-π相互作用、阳离子-π相互作用以及孔隙扩散与LEV发生作用。
3 结论
(1)以表面活性剂十二烷基二甲基苄基氯化铵(BKC)为改性试剂,聚多巴胺(PDA)为包覆试剂,成功制备了一类明胶-改性氧化石墨烯-聚多巴胺复合气凝胶(GGB),通过SEM,FTIR,XPS等表征分析表明,GO被BKC成功改性,GGB具有三维多孔网络结构并且含有—OH,—COOH,—NH2等官能团。
(2)相对于复合未改性GO的复合气凝胶GGO,GGB对于水体中盐酸左氧氟沙星(LEV)的平衡吸附量明显优于GGO,超过了GGO对LEV平衡吸附量的3倍。吸附实验数据拟合符合准二级动力学模型和Langmuir吸附等温模型,在298 K下拟合所得最大理论吸附量为476.42 mg/g,表明GGB吸附LEV的过程主要属于受化学吸附过程控制的单分子层吸附。同时,吸附热力学研究表明整个吸附过程是自发进行的放热反应,并且经过5次循环,GGB对LEV的平衡吸附量仍超过了80 mg/g,表明该复合气凝胶具有吸附处理水体中LEV的潜力。
(3)通过机理分析表明,复合气凝胶GGB可能是通过静电作用、氢键相互作用、π-π相互作用、阳离子-π相互作用以及孔隙扩散与抗生素LEV发生反应。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。
相关文章
无相关信息

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414
点击排行
PPT新闻
“海洋金属”——钛合金在舰船的
点击数:10028
腐蚀与“海上丝绸之路”
点击数:7814