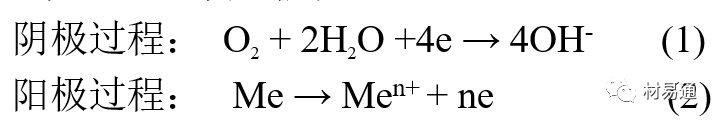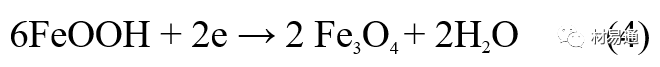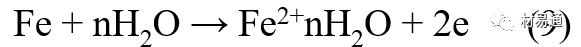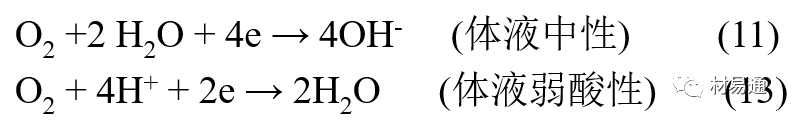金属腐蚀是指在环境介质的化学作用下,在和物理、机械或生物学因素的共同作用下金属产生的破坏,即金属在它所处环境的作用下所产生破坏。
本期主要介绍金属在不同环境中的腐蚀,包括在大气中、海水中、土壤中、工业环境以及人体环境中的腐蚀情况。
金属在大气中的腐蚀
01 大气腐蚀概述
金属材料或构筑物在大气条件下发生化学或电化学反应引起材料的破损称为大气腐蚀。大气腐蚀是常见的一种腐蚀现象。全世界在大气中使用的钢材量一般超过其生产总量的60%。例如,钢梁、钢轨、各种机械设备、车辆等都是在大气环境下使用。大气腐蚀而损失的金属约占总的腐蚀量的50%以上,因此了解和研究大气腐蚀的机理、影响因素及防止方法是非常必要的。
02 大气腐蚀分类
全球范围大气主要成分几乎不变的,其中的水分含量将随地域、季节、时间等条件而变化。参与大气腐蚀过程的是氧和水气,二氧化碳。根据金属表面的潮湿程度的不同,把大气腐蚀分为三类:
1)干大气腐蚀。干大气腐蚀是在金属表面不存在液膜层时的腐蚀。特点是在金属表面形成不可见的保护性氧化膜(1~10nm)和某些金属失泽现象。如铜、银等在被硫化物污染的空气中所形成的一层膜。
2)潮大气腐蚀。潮大气腐蚀是指金属在相对湿度小于100%的大气中,表面存在肉眼看不见的薄的液膜层(10nm~1μm)发生的腐蚀。如铁没受雨淋也会生锈。
3)湿大气腐蚀。湿大气腐蚀指金属在相对湿度大100%,如水分以雨、雾、水等形式直接溅落在金属表面上,表面存在肉眼可见的水膜(1μm ~1mm)发生的腐蚀。
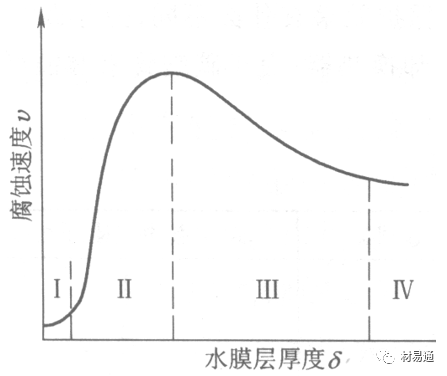
图1大气腐蚀速度与金属表面水膜厚度的关系
根据上图解释腐蚀速度与水膜厚度的规律:
1)区域I 金属表面只有约几个水分子厚(1~10nm)水膜,还没有形成连续的电解质溶液,相当于干的大气腐蚀.腐蚀速度很小。
2)区域II 金属表面水膜厚度约在1μm时,由于形成连续电解液层,腐蚀速度迅速增加,发生潮的大气腐蚀。
3)区域III 水膜厚度增加到1mm时,发生湿的大气腐蚀,氧通过该膜扩散到金属表面显著困难,因此腐蚀速度明显下降。
4)区域IV 金属表面水膜厚度大于1mm,相当于全浸在电解液中的腐蚀,腐蚀速度基本不变。
通常所说的大气腐蚀是指在常温下潮湿空气中的腐蚀。
03 大气腐蚀机理
大气腐蚀特点是金属表面处于薄层电解液下的腐蚀过程,腐蚀规律符合电化学腐蚀规律。
当金属表面形成连续的电解液薄层时,大气腐蚀的阴极过程主要是氧去极化。
铁、锌等金属全浸在还原性酸溶液中,阴极过程主要是氢去极化,城市污染的大气所形成的酸性水膜下,这些金属的腐蚀主要是氧去极化腐蚀。
在薄液膜下,阳极过程受较大阻滞,氧更易到达金属表面,生成氧化膜或氧的吸附膜,使阳极处于钝态。阳极钝化及金属离子化过程困难造成阳极极化。
当液膜增厚,相当于湿的大气腐蚀时,氧到达金属表面有一个扩散过程,腐蚀过程受氧扩散过程控制。
潮的大气腐蚀主要受阳极过程控制; 湿大气腐蚀主要受阴极过程控制。
大气腐蚀条件不同,锈层成分和结构是很复杂的。Evans认为大气腐蚀的锈层处在潮湿条件下,锈层起强氧化剂作用,在锈层内阳极反应发生在金属/Fe3O4界面上:
阴极反应发生在Fe3O4/FeOOH界面上:
锈层参与了阴极过程,图2为Evans锈层模型图。
由图可见,锈层内发生Fe3+→Fe2+的还原反应,锈层参与了阴极过程。
锈层干燥时,外部气体相对湿度下降时,锈层和底部基体钢在大气中氧的作用下,锈层重新氧化成Fe3+的氧化物,在干湿交替的条件下,锈层加速钢腐蚀过程。碳钢锈层结构一般分内外两层:
内层紧靠钢和锈的界面上,附着性好,结构较致密,主要由致密的带少许Fe3O4晶粒和非晶FeOOH构成;
外层由疏松的结晶α-FeOOH和γ-FeOOH构成。
锈层生成的动力学如图3所示,其曲线遵循幂定律;
P—失重量;K—常数;t—暴露时间;n—常数。
上式也适用于钢的镀锌和镀铝层及W(A1)=55%的Al-Zn镀层的大气试验数。
04 工业大气中金属腐蚀特点
工业大气中的SO2、NO2、H2S、NH3等都增加大气的腐蚀作用,加快金属的腐蚀速度.
石油、煤等燃科的废气中含SO2最多,在城市和工业区SO2的含量可达0.1~100mg/m3。
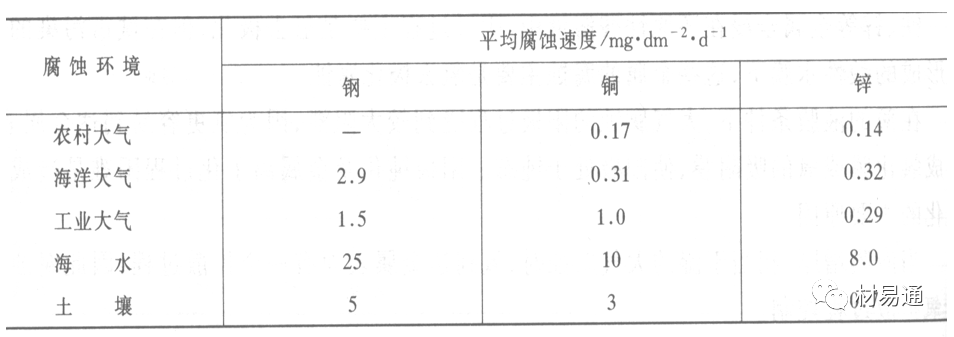
常用金属在不同大气环境中的平均腐蚀速度。
1)Air很纯时,腐蚀速度很小,随湿度增加仅有轻微增加。
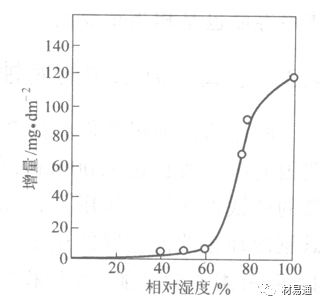
2)在污染的空气中,空气相对湿度低于70%时,即便长期暴露,腐蚀速度也是很慢。但SO2有存在的条件下,当相对湿度略高于70%时,腐蚀速度急剧增加。
3)被硫酸铵和煤烟粒子污染的空气加速金属腐蚀。
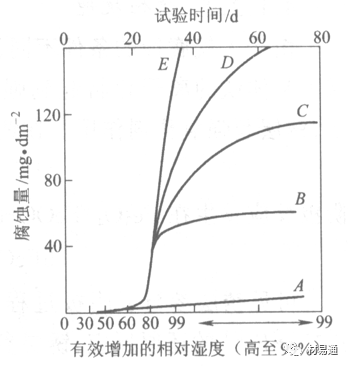
图中A-纯净空气, B-有(NH4)2SO4, C-0.01%SO2, D-(NH4)2SO4+0.01%SO2, E-烟粒+0.01%SO2。
污染Air,低于临界湿度,金属表面没有水膜,金属受化学作用引起的腐蚀,腐蚀速度很小。高于临界湿度,水膜的形成,电化学腐蚀,腐蚀速度急剧增加。
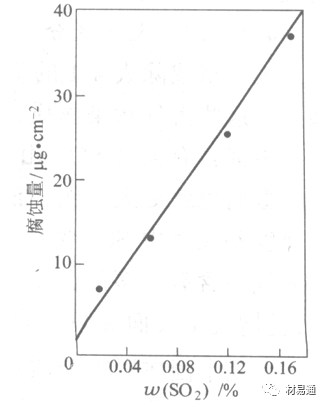
大气中SO2对不耐H2SO4腐蚀的金属,如Fe、Zn、Cd、Ni的影响十分明显。呈直线关系上升。
SO2促进金属大气腐蚀的机制
SO2的腐蚀作用机制是硫酸盐穴自催化过程。
SO2促进金属大气腐蚀的机制,主要有两种方式:
一是部分SO2在空气中能直接氧化成SO3,SO3溶于水形成H2SO4;
二有一部分SO2吸附在金属表面上,与Fe作用生成易溶的硫酸亚铁,FeSO4进一步氧化并由于强烈的水解作用生成了H2SO4,H2SO4再与Fe作用,按这种循环方式加速腐蚀。
整个过程具有自催化作用,即所谓锈层中硫酸盐穴的作用。
锈层中硫酸盐穴的作用
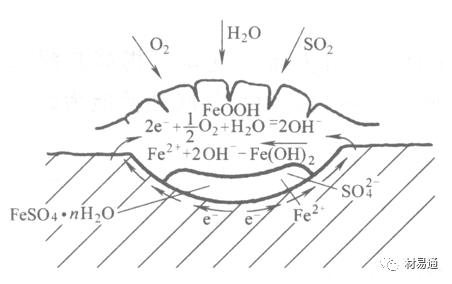
Schwarz:锈层内FeSO4生成机构如图下所示的模型。锈层的保护能力受其形成时占主导地位的条件影响。如生成的锈层被硫酸盐侵蚀,锈层几乎无保护能力。相反,如最初锈层很少受硫酸盐污染,其保护性较好。
图5 锈层内FeSO4生成机构
05 影响大气腐蚀的因素及防蚀方法
湿度
湿度是决定大气腐蚀类型和速度的一个重要因素。把大气腐蚀速度开始剧增时的大气相对湿度值称为临界湿度。对于铁、钢、铜、锌,临界湿度约在70%~80%之间。由图7可见,湿度小于临界湿度,腐蚀速度很慢,几乎不腐蚀。若把湿度降至临界湿度以下,可防止金属发生大气腐蚀。
图7 铁在质量分数为0.01%的SO2的空气中经55天后
大气成分
地理环境不同,有SO2、H2S、NaCl及尘埃等杂质。它们不同程度地加速腐蚀。特别是SO2。煤、石油燃烧的废气中都含有大量SO2, 冬季燃料消耗多,SO2污染更严重,对腐蚀的影响也就更大。
铁、锌等金属在SO2大气中生成易溶的硫酸盐化合物,它们的腐蚀速度和大气中SO2含量呈直线关系上升。
海洋大气中含有较多的微小的NaCl颗粒,它们落在金属的表面上,有吸湿作用,增大了表面液膜层的电导,氯离子本身有很强的侵浊性,因而使腐蚀变得更严重。
大气中固体颗粒称为尘埃。其组成复杂,除海盐粒外,还有碳和碳化物、硅酸盐、氮化物、铵盐等固体颗粒。城市大气中尘埃含量约2mg/m3,工业大气中的尘埃甚至可达1000mg/m3以上。
尘埃对大气的影响有以下几点:
1)尘埃本身具有腐蚀性,如铵盐颗粒能镕入金属表面的水膜,提高电导或酸度促进腐蚀。
2)尘埃本身无腐蚀作用,但能吸附腐蚀物质,如碳粒能吸附SO2和水气生成腐蚀性的酸性溶液。
3)尘埃沉积在金属表面形成缝隙而凝聚水分,形成氧浓差引起缝隙腐蚀。
露置在大气环境中的金属构件和仪器设备应当防尘。
防止大气腐蚀的方法:
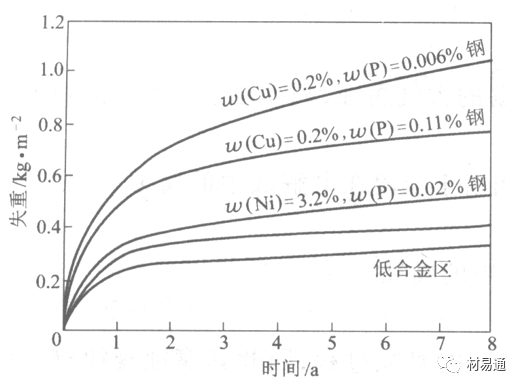
1)提高金属材料的耐蚀性 在碳钢中加入Cu、P、Cr、Ni及稀土元素可提高其耐大气腐蚀性能。例如,美国的Cor-Ten钢(Cu-P-Cr-Ni系低合金钢),其耐大气腐蚀性能为碳钢的4~8倍。
2)采用有机和无机涂层及金属镀层。
3)采用气相缓蚀剂。
4)降低大气湿度, 主要用于仓储金属制品的保护。
合理设计构件.防止缝隙中存水,去除金属表上的灰尘等都有利于防蚀, 开展环境保护,减少大气污染,不仅有利于人民健康, 而且对延长金属材料在大气中使用寿命也是相当重要的。
金属在海水中的腐蚀
01 海水腐蚀概述
海洋占地球表面积70%,海水是自然界中数量最大且具有腐蚀性的天然电解质。我国海岸线长达18000km,海域广阔。沿海地区的工厂常用海水作为冷却介质,冷却器的铸铁管在海水作用下,一般只能使用3~4年;海水泵的铸铁叶轮只能使用3个月左右;碳钢冷却箱的内壁腐蚀速度可达1mm/a以上。近年来海洋开发受到重视,海上运输工具、海上采油平台,开采和水下输送及储存设备等金属构件受到海水和海洋大气腐蚀的威胁愈来愈严重;研究海洋环境中金属的腐蚀及其防护有重要意义。
02 海水腐蚀特点
盐类及导电率
海水为腐蚀性介质,特点是含多种盐类,盐分中主要是NaCl,常把海水近似地看作质量分数为3%或3.5%的NaCl溶液。
盐度是指1000g海水中溶解固体盐类物质的总克数,一般海水的盐度在3.2%~3.75%之间,通常取3.5%为海水的盐度平均值。海水中氯离子的含量很高,占总盐量的58.04%,使海水具有较大的腐蚀性。
海水平均电导率为4×10-2S/cm,远超过河水和雨水的电导率。
溶解氧
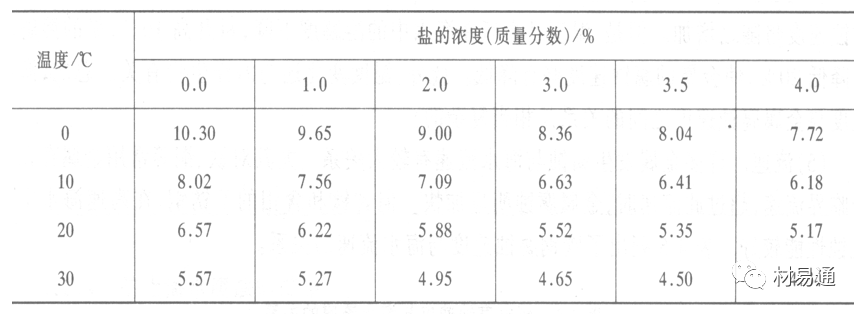
海水中溶解氧,是海水腐蚀的重要因素。正常情况下海水表面层被空气饱和,氧的浓度随水温一般在(5~10)×10-6cm3/L范围内变化。由表看出盐的浓度和温度愈高,氧的溶解度愈小。
表1 氧在海水中的溶解度
海水的电化学特点
1)多数金属,除特别活泼金属镁及其合金外,海水中的腐蚀过程都是氧去极化过程, 腐蚀速度由氧扩散过程控制。
2)大多数金属(铁、钢、锌等),在海水中发生腐蚀时,阳极过程的阻滞作用很小,海水中Cl-离子浓度高,海水中用增加阳极阻滞方法来减轻海水腐蚀的可能性不大,添加合金元素钼,才能抑制Cl-对钝化膜的破坏作用,改进材料在海水中的耐蚀性。
3)海水电导率很高,电阻性阻滞很小,对海水腐蚀,微观电池的活性较大,宏观电池活性也较大。在海水中,异种金属接触引起的电偶腐蚀有相当大的破坏作用。如舰船的青铜螺旋桨可引起远达数十米处的钢船壳体的腐蚀。
4)海水中金属易发生局部腐蚀破坏。如点蚀,缝隙腐蚀,湍流腐蚀和空泡腐蚀等。
03 影响海水腐蚀的因素
海水中盐类,溶解氧、海洋生物和腐烂的有机物,海水的湿度、流速与pH值等都对海水腐蚀有很大的影响。
1)盐类。
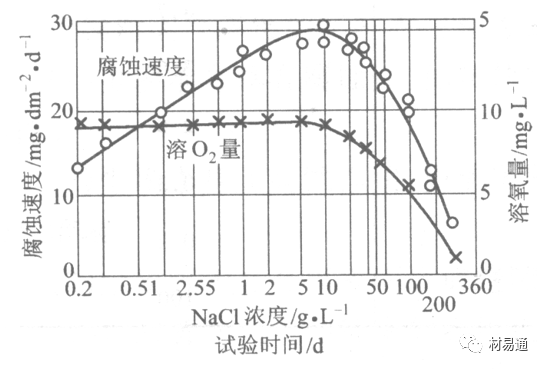
以NaCl为主,海水中盐的浓度与钢的腐蚀速度最大的盐浓度范围相近,当溶盐浓度超过一定值,因氧溶解度降低,金属腐蚀速度下降,见图8。
2)pH值。海水pH值在7.2~8.6之间。pH值可因光合作用而稍有变化;在深海处pH值略有降低, 不利于金属表面生成保护性的盐膜。
3)溶解氧。海水中的溶解氧是海水腐蚀的重要因素。大多数金属在海水中的腐蚀受氧去极化作用控制。
溶解氧含量随海水深度不同而变化. 海水表面与大气接触含氧量高达12×10-6。海平面至-800m深处,含氧量逐渐减少并达到最低值; 海洋动物要消耗氧气;-800m再降-1000m,溶氧量又上升,接近海水表面的氧浓度,因为深海水温度较低、压力较高的缘故。
4)温度。海水温度每升高10℃,化学反应速度提高约10%,海水中金属的腐蚀速度将随之增加。但温度升高,氧在海水中的溶解度下降,每升高10℃,氧的溶解度约降低20%,使金属的腐蚀速度略有降低。
温度变化与海洋生物有关。海水温度与金属腐蚀速度之间的关系是相当复杂的。
5)流速。许多金属发生腐蚀与海水流速有较大关系。尤其对铁、铜等常用金属存在一个临界流速,超过此流速时,金属腐蚀明显加快。但含钛和含钼的不锈钢,在高速海水中的抗蚀性能较好
6)海洋生物 海洋生物在船舶或海上构筑物表面附着形成缝隙,易诱发缝隙腐蚀。
微生物的生理作用会产生氨、CO2和H2S等腐蚀物质,如硫酸盐还原菌作用产生S2- ,会加速金属腐蚀。
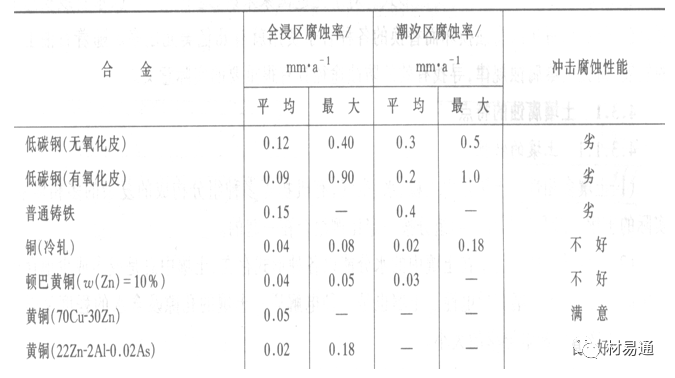
04 水中常见金属材料的耐蚀性
金属材料在海水中的耐蚀性差别很大,耐蚀性最好的是钛合金和Ni-Cr合金,而铸铁和碳钢耐蚀性较差。不锈钢的均匀腐蚀速度虽然很小,但在海水中易产生点蚀。常用金属材料耐海水腐蚀性能见表2。
05 防止海水腐蚀的措施
1)研制和应用耐海水腐蚀的材料;如钛、镍、铜及其合金,耐海水钢(Mariner)。
2)阴极保护 腐蚀最严重处采用护屏保护较合理,亦可采用简易可行的牺牲阳极法。
3)涂层 除应用防锈油漆外,还可采用防止生物沾污的双防油漆,对于潮汐区和飞溅区的某些固定的钢结构可以使用蒙乃尔合金包覆。
金属在土壤中的腐蚀
01 土壤腐蚀概述
土壤是由土粒、水溶液、气体、有机物、带电胶粒和粘液胶体等多种组分构成的极为复杂的不均匀多相体系。因土壤的组成和性能的不均匀,极易构成氧浓差电池腐蚀,使地下金属设施遭受严重局部腐蚀。埋在地下的油、气、水管线以及电缆等因穿孔而漏油、漏气或漏水。或使电信设备发生故障。这些往往很难检修,带来很大的损失和危害。
土壤腐蚀是一种很重要的腐蚀形式。先进国家,地下的油、气百万公里以上,每年因腐蚀损坏而替换的各种管子费用就有几亿美元之多。随石油工业的发展,研究土壤腐蚀规律,寻找有效的防蚀途径具有很重要的实际意义。
02 壤腐蚀特点
土壤特性
1)土壤多相性。土壤是由土粒、水、空气,有机物等多种组分构成的复杂的多相体系。实际的土壤一般是这几种不同组分按一定比例组合在一起的。
2)土壤导电性。由于在土壤中的水分能以各种形式存在,土壤中总是存在一定的水分,因此土壤有导电性。土壤也是一种电解质。土壤的孔隙及含水的程度又影响着土壤的透气性和电导率的大小。
3)土壤不均匀性。土壤中氧气,有溶解在水中,有存在于土壤的缝隙中。土壤中氧浓度与土壤的湿度和结构都有密切关系,氧含量在干燥砂土中最高,在潮湿的砂土中次之,而在潮湿密实的粘土中最少。这正是造成氧浓差电池腐蚀的原因。
4)土壤的酸碱性。
大多数土壤是中性的,pH值在6.0~7.5之间。 有的土壤是碱性的,如我国西北的盐碱土pH值为7.5~9.0; 一些土壤是酸性的,如腐殖土和沼泽土pH值为3~6。一般认为pH值越低,土壤腐蚀性越大。
大多数金属在土壤中的腐蚀都属于氧去极化腐蚀。金属在土壤中的腐蚀与在电解液中的腐蚀本质是一样的。以Fe为例:
阳极过程:
阳极反应速度主要受金属离子化过程难易程度控制。 在pH值低的土壤中,OH-很少。由于不能生成Fe(OH)2,Fe2+离子浓度在阳极区增大。在中性和碱性土壤中生成的Fe(OH)2溶解度很小, 沉淀在钢铁表面上,对阳极溶解有一定的阻滞作用。土壤中含有碳酸盐, 可能在阳极表面生成不溶性沉积物,起保护膜的作用。土壤中氯离子和硫酸根离子能与Fe2+离子生成可溶性的盐,加速阳极溶解。
阴极过程:
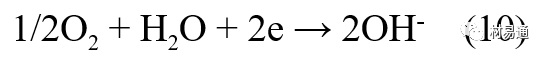
在弱酸性、中性和碱性土壤中,阴极反应主要是氧的去极化作用。土壤中的水溶解氧是有限的,对土壤腐蚀起主要作用的是缝隙和毛细管中的氧。土壤中的传递过程比较复杂,进行得也比较慢。在潮湿的粘性土壤中,由于渗水能力和透气性差, 氧的传递是相当困难的,使阴极过程受阻。当土壤水分的pH值大于5时,腐蚀产物能形成保护层。
03 土壤腐蚀的形式
充气不均匀引起的腐蚀
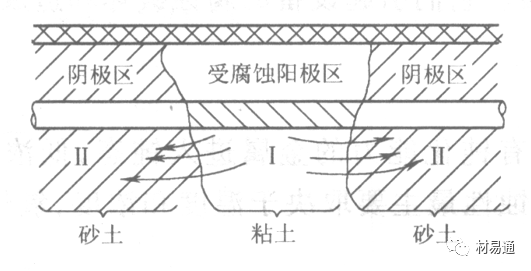
这种腐蚀主要指地下管线穿过不同的地质结构及潮湿程度不同的土壤带时,由于氧浓度差别引起的宏观电池腐蚀,如图9。
图9 管道在结构不同的土壤中所形成的氧浓差电池
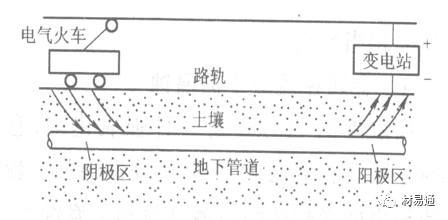
杂散电流引起的腐蚀
杂散电流是一种漏电现象。来源用直流电的大功率电气装置,电气铁路,电解及电镀、电焊机等装置。图10为杂散电流腐蚀实例示意图。
图10
铁轨与土壤间的绝缘不良,有一部分电流就会从铁轨漏失到土壤中。铁轨附近埋设有金属管道,杂散电流经土壤进入金属管道后,再经土壤及轨道返回到电源。这相当两个宏观电池作用:铁轨-阳极,土壤-电解质,管道-阴极,管道-阳极,土壤-电解质,铁轨(地面)-阴极。
微生物引起的腐蚀
对腐蚀有作用的细菌不多,其中最重要的是硫酸杆菌和硫酸盐还原菌(厌氧菌)。
这两种细菌能将土壤中硫酸盐还原产生S2-,其中小部分消耗在微生物自身的新陈代谢上,大部分可作为阴极去极化剂, 促进腐蚀反应。
土壤的pH值在4.5~9.0时,最适宜硫酸盐还原菌生长; 11 <pH值<3.5时,这种菌的活动及生长就很难了。
04 止土壤腐蚀的措施
1) 采用涂料或包覆玻璃布防水;
2) 采用电化学保护,多采用牺牲阳极法,阴极保护与涂料联合使用效果更好;
3) 采用金属涂层或包覆金属,镀锌层等。
金属在工业环境中的腐蚀
01 金属在酸溶液中的腐蚀
酸是一类能在水溶液中电离,形成H3O+离子化合物的总称。一般用H+代表H3O+。
氧化性酸与非氧化性酸对金属的腐蚀情况大不相同。
腐蚀过程中,非氧化性酸的特点是腐蚀的阴极过程基本上是氢去极化过程,增加溶液酸度相应地会增加阴极反应,并使金属腐蚀速度增加。
氧化性酸的特点是阴极过程主要是氧化剂的还原过程引起金属腐蚀(如硝酸根还原成亚硝酸根)。但氧化性酸浓度超过某一临界值时,使钝化型金属进入钝态,抑制了腐蚀。酸溶液腐蚀性一方面与酸的强弱,同时也与酸的阴离子的氧化能力有关。
工业无机酸有硫酸、硝酸、盐酸, 他们引起的设备腐蚀破坏和造成的经济损失相当严重。
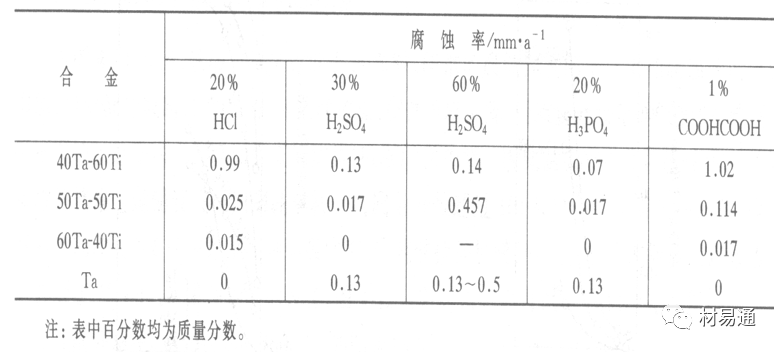
金属在硫酸中的腐蚀:
高浓度H2SO4是强氧化剂,能使具有钝化能力的金属进入钝态,低浓度的H2SO4则没有氧化能力,其腐蚀性很强。
硫酸的腐蚀性最主要取决于温度和浓度,氧化剂、流速等也能影响硫酸对各种材料的腐蚀性。
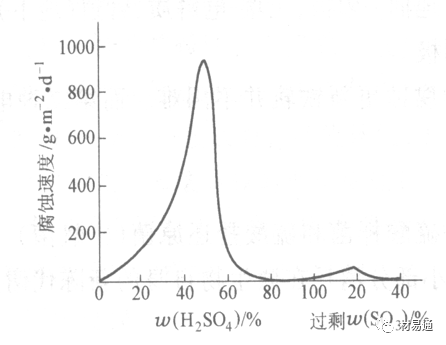
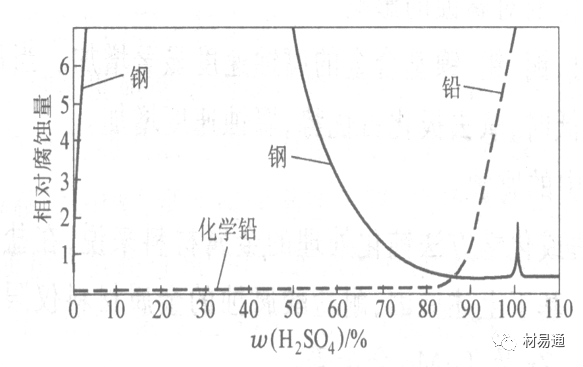
工业上耐硫酸的材料为价廉的碳钢和铅及铅合金,图11、图12分别显示出铁、铅的腐蚀速度与硫酸质量分数的关系。
图11 铁的溶解速度与硫酸浓度的关系
铁的腐蚀速度与硫酸质量分数的关系
硫酸质量分数低于50%时,碳钢的腐蚀速度随浓度增加腐蚀速度急剧增加;
当质量分数超过50%时,随浓度增加,腐蚀急剧下降;
当质量分数超过70%时,碳钢几乎不腐蚀。钢表面生成硫酸盐(FeSO4)保护膜。因此制造质量分数超过70%的浓硫酸的储罐与运输管线可用钢铁材料。
当质量分数超过101%的中温发烟H2SO4时,应注意两个问题:①浓H2SO4是一种强吸水剂;②硫酸盐保护膜(FeSO4)易受破坏。
当硫酸质量分数低于70%时,应采用铅制的设备,铅表面可以生成PbSO4的保护膜。在硫酸环境中,钢和铅具有互补性。
图12 铅的腐蚀速度与硫酸浓度的关系
在硫酸环境中,钢和铅具有互补性.
图 13 钢和铅的腐蚀规律(常温)
流速对腐蚀影响
表3示出了输送H2SO4时浓度与流动速度对钢管寿命的影响。随浓度增加,流速增大,钢管寿命降低,输送硫酸时,不宜采用高的流动速度.
表3 硫酸输送管的寿命与硫酸浓度的关系
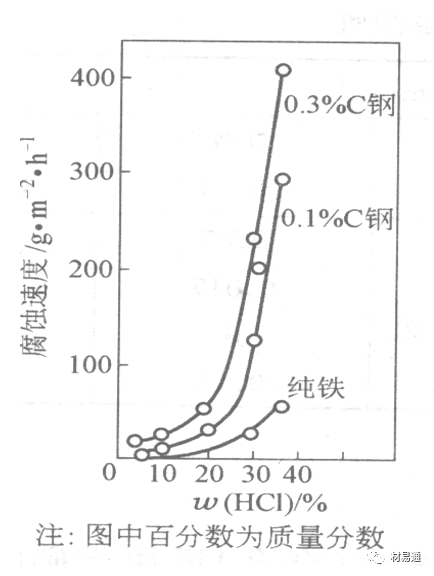
金属在盐酸中的腐蚀
HCl强酸, 除银、钛等少数金属外,大多数金属或合金在HCl中都不能生成难溶的金属盐膜。
HCl中Cl-有极强性,除钛等少数钝性优异的金属外,金属表面的钝化膜在盐酸中都因受到氯离子的破坏而发生点蚀。
a 盐酸浓度与腐蚀速度的关系
工业纯铁与碳钢的腐蚀速度随盐酸的浓度成指数关系增加,钢不能用于盐酸介质中。
沸HCl中各种金属腐蚀速度与HCL浓度关系
盐酸中溶氧或氧化剂对腐蚀的影响
HCl中存在氧化剂时,铜、钼、镍基合金的腐蚀速度显著增加。当HCl浓度高时,阴极为氢去极化,但当盐酸浓度低时,氧去极化占优势,腐蚀速度增加。
钝态金属在盐酸中的腐蚀
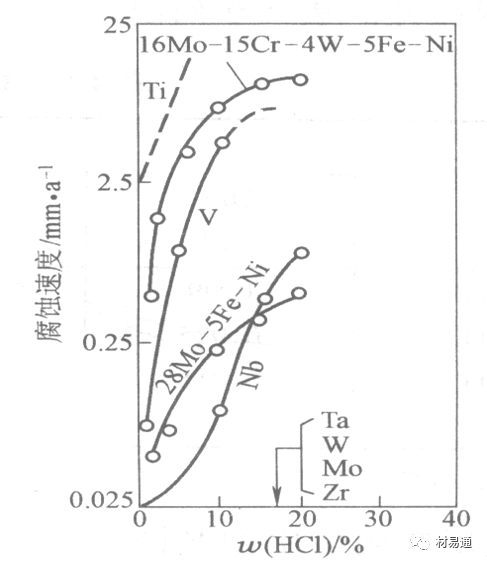
对可电化学方法或化学方法钝化处理的金属材料,在HCl中它们的钝态区很窄或不存在。因此,耐HCl腐蚀的金属材料仅限于有极强钝化性能特殊金属及合金,如Ta、Zr及Ti-Mo合金等。
耐盐酸腐蚀的材料
1)Ti-Mo合金
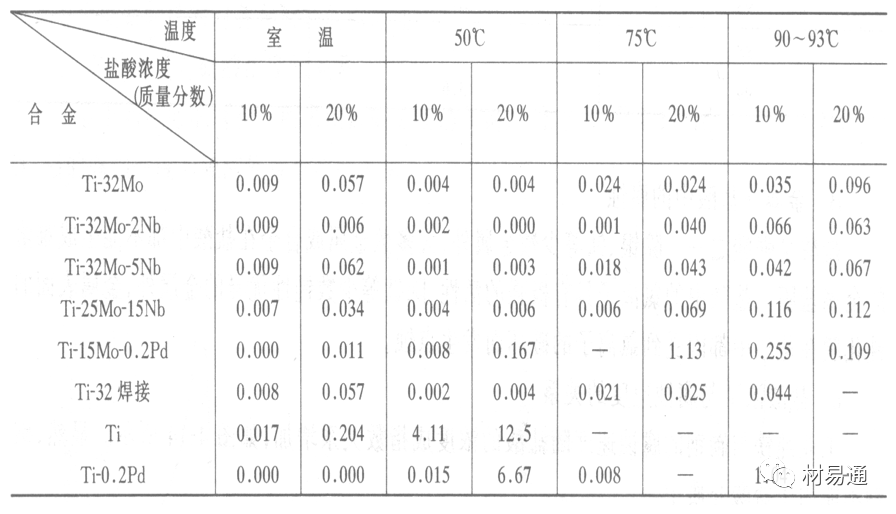
耐蚀Ti合金的研制是为改善纯Ti在强还原介质中的耐蚀性。W.L.Finlay发现Ti-Mo合金对强还原性硫酸、盐酸具有优异的耐蚀性。Ti-30~40Mo合金在沸腾的质量分数为20%的HCl中的腐蚀率为10mm/a; 工业纯钛只能用于室温质量分数为3%~10%的HCl中 当前Ti-30Mo、Ti-32Mo是在还原性酸中最耐蚀的Ti合金,不合稀贵金属,因而受到广泛重视。
表5 Ti合金在HCl中的腐蚀率/mma-1
2)Ti-Ta合金
钽能提高Ti在还原性介质中的耐蚀性,且能改善钛在氧化性介质中的耐蚀性。
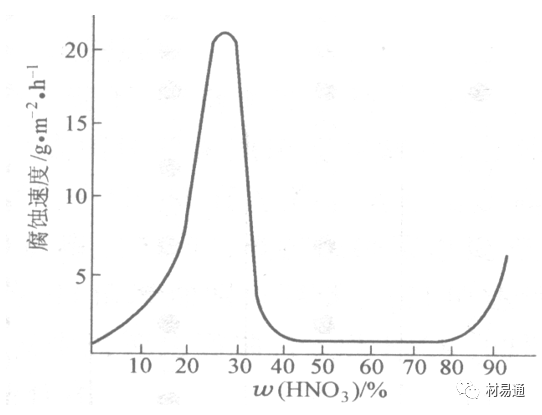
金属在硝酸中的腐蚀
HNO3氧化性的强酸,在其中能钝化的金属适用于HNO3,Ag、Ni、Pb、Cu不耐硝酸腐蚀。
1)碳钢。碳钢在HNO3中的腐蚀行为见图16
02 不同钢在硝酸中的腐蚀行为
1)碳钢
硝酸质量分数低于30%时,碳钢的腐蚀速度随酸浓度增加而增加,当质量分数约在30%附近时腐蚀速度达到最大值。
质量分数超过30%,腐蚀速度迅速下降;
质量分数达到50%时,腐蚀速度最小, 说明钢钝化了。当质量分数超过80%时,碳钢的腐蚀速度再次急剧增加,钢出现过钝化溶解。
铁或钢适用于HNO3浓度在30%~80%(质量分数)范围内。
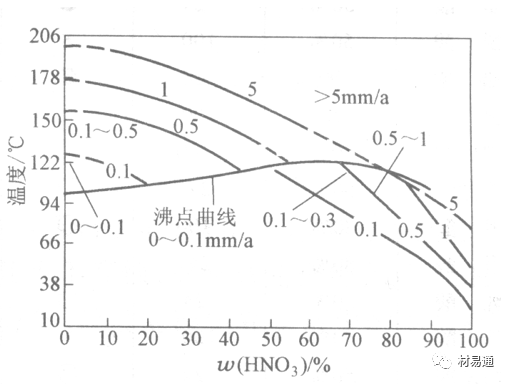
2)不锈钢。
对硝酸有良好的耐蚀性。图4-17是18-18不锈钢在硝酸中腐蚀图。不锈钢是硝酸系统中大量使用的耐蚀材料,如硝铵、硝酸生产中大部分设备都是用不锈钢制造的。浓度超过70%热硝酸中易发生过钝化腐蚀。
3)Al及其合金。
对中等温度的发烟HNO3良好蚀性,[HNO3]<85%时,在室温,Al耐蚀性也不好。
4)高硅铸铁。
Si质量分数>13%合金铸铁称为高硅耐酸铸铁。对各种无机酸包括盐酸均有良好的耐蚀性。
高硅铸铁中Si的质量分数一般不超过15%,否则会生成介稳定的脆性η相(Fe5Si2)。
金属在人体环境中的腐蚀
01 金属植入材料
植入材料是指用于制造人体内部的人工器官、小型监测仪器和治疗装置等植入器件。
整形外科中用于修复人体所使用的材料,以及用于义齿及人工齿根等方面的材料。植入材料也称生物医学材料。
特定的金属材科、有机高分子材料和陶瓷材料。陶瓷材料即生物陶瓷材料,目前尚不成熟,高分子材料中只有超高分子聚乙烯是目前国际上普遍采用的人工关节塑料材料。
金属植入材料在人体内应用部位是多种多样的,人体具有高度腐蚀性的环境,对金属植人材料的耐腐蚀性能的要求是相当重要的。
02 人体环境特点
人体环境由体液构成。体液(生理液)是质量分数约1%的NaCl、少量其他盐类及有机化合物的充气溶液。温暖的海水相似。
人体环境复杂,活体,对其变化规律还缺乏足够认识。
金属植入材料在人体环境中可能发生多种腐蚀行为交织在一起,互相影响。
人体敏感性,要求植入材料达到很好修复和治疗目的,应对周围的组织、血液及对人体不产生有害的影响。
体液是典型电解质溶液, 电化学腐蚀基本规律对人体环境中植入材料的腐蚀完全适用。体液一般pH值中性,有时几何原因或生理条件限制,导致氧的供应受限,局部体液成弱酸性,含H+,植入材料易点蚀。
金属植入材料腐蚀属于氧去极化腐蚀,其阴极过程:
阳极过程:
微电池阳极反应是金属失掉电子的溶解反应,造成金属离子迁移,植入金属部件患者体液以及植入部件周围的组织中存在着钴、铬、镍、钼、钛等金属离子。它们能否引起新陈代谢异常,对人体有干扰和毒性,这和植入材料耐蚀性与生物相溶性密切相关。
植入材料可能发生的腐蚀形态与工业金属材料腐蚀破坏形式基本相同.因发生在特定的人体环境中,腐蚀危害更大。
03 人体环境中可能发生的腐蚀形式
1)均匀腐蚀
人体中,植入材料腐蚀减薄而丧失结构强度不是主要问题,问题是均匀腐蚀产物的生物相容性,增加病人痛苦甚至危及生命。
人体中金属植入材料均匀腐蚀速度比一般工业材料的腐蚀速度低2~3个数量级。均匀腐蚀是大面积上发生,金属离子进入到人体组织里的量还是相当可观的。对金属植入材料耐均匀腐蚀性能的要求更高,年失厚率应该不大于0.254μm。由于钛的钝化性能非常好.所以在外科植入材料中是令人满意的。
2)点腐蚀
点腐蚀条件及破坏见3.2节。植入的金属材料有不锈钢、钴基、铁基合金,均系易钝化合金,有钝化膜。人体中用的不锈钢耐蚀性能不太令人满意。钴铬合金植入器件的强制取出率为3%,且未见明显点腐蚀,而316不锈钢的点腐蚀明显。
模拟生理盐液点蚀倾向研究表明,钛合金及钴铬钼合金点蚀倾向非常小,而不锈钢点蚀倾向大。含Mo的不锈钢抗点蚀,但Mo含量不足也会发生点蚀。对承载力大与骨骼部件,最好采用抗点蚀的不锈钢及钛合金。
3)电偶腐蚀
电偶腐蚀在多个零件构成的植入器件中尤其重要。
如果选用材料不同(电位差异)就容易产生电偶腐蚀。
如骨板和螺钉。
手术器械与植人材料间也可能引起电偶腐蚀。金属切屑与未经过强烈变形的同种材料接触时也会引起电偶腐蚀。
4)缝隙腐蚀
多零件植入装置,特别是骨板和螺钉,会遭受缝隙腐蚀,不锈钢植入器件的缝隙腐蚀是一种重要腐蚀现象。取出的多零件植入装置中,有50%遭缝隙腐蚀。强制取出率表明,缝隙腐蚀仅次于均匀腐蚀。
5)磨损腐蚀、晶间腐蚀
磨损腐蚀是由于植入器件之间反复的、相对的滑动所造成的表面磨损与腐蚀环境的综合作用结果。
晶间腐蚀是不锈钢最易发生的一种腐蚀形式,其危害是相当严重的。
制作医用不锈钢植入器件过程中必须避开材料的敏化温度。
碳的质量分数降到0.03%以下,可以消除不锈钢的晶间腐蚀。现用的医用不锈钢按ISO832/1国际标准规定,C的质量分数均低于0.03%。
6)腐蚀疲劳
金属材料在交变应力与介质的共同作用下产生的断裂现象为腐蚀疲劳。
人体下肢所用的植入器件,特别是髋关节植入器件,耐腐蚀疲劳性能是至关重要的。
腐蚀疲劳裂纹是从植人器件表面发生,对植入器件进行喷丸处理可提高疲劳寿命。
铸造合金对腐蚀疲劳是敏感的,临床表明锻造合金对腐蚀疲劳断裂敏感性小得多。
对承受高应力植入器件优先考虑采用热压和锻造的方法制造。
04 常用金属植入材料
植入材料的要求
人体环境的复杂程度几乎无法模拟。对植入材料耐蚀性要求更高。
对植入材料要求主要有三个方面:材料与人体的生物相容性、在人体环境中的耐腐蚀性能以及植入材料的力学性能。
生物相容两个方面:一是人体组织对植入材料的作用,即植入材料的腐蚀、断裂、失效;另一个是植入材料腐蚀产物、磨损产物对人体组织的作用。
常用金属植入材料有不锈钢、钴铬钼合金及钛合金。
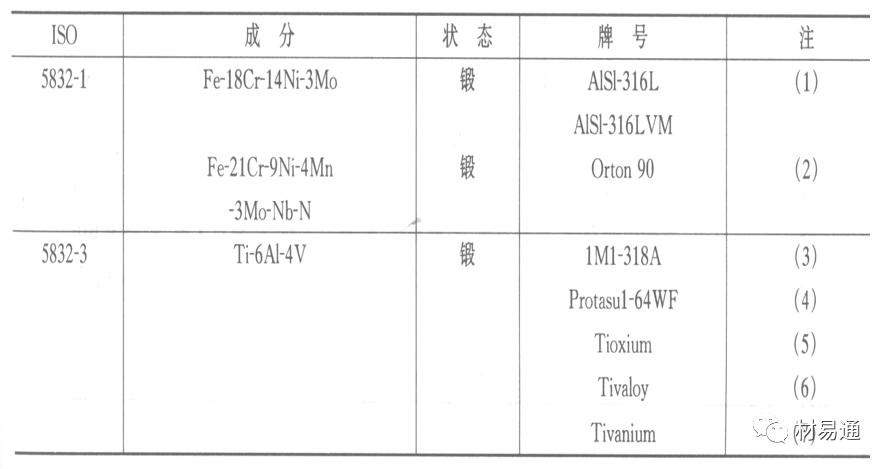
人工髋关节使用的金属植入材料
可植入不锈钢的力学性能
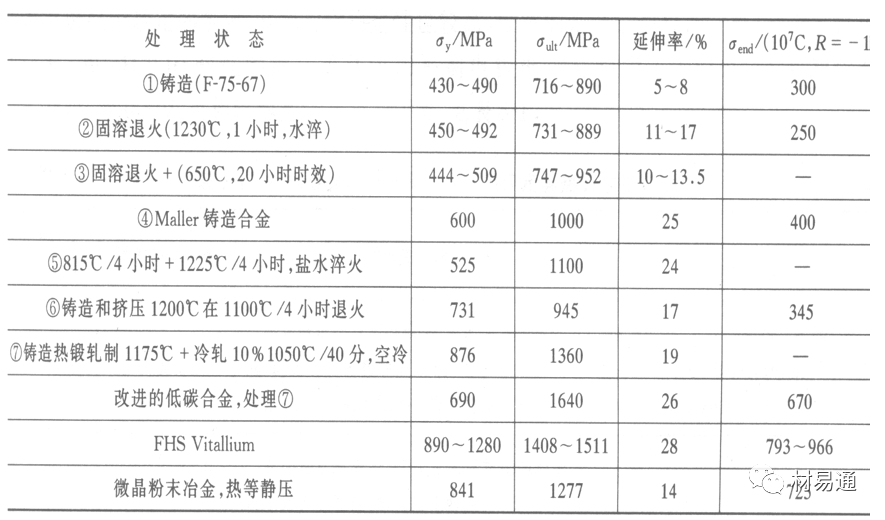
Co-Cr-Mo合金的力学性能
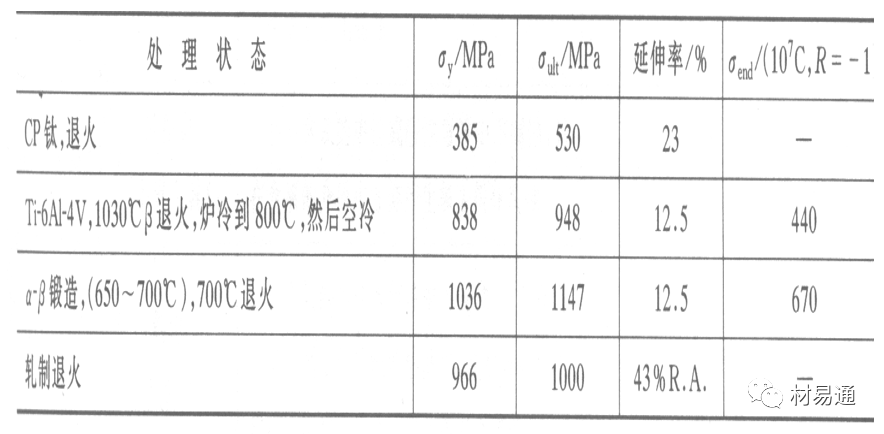
钛 及其合金的力学性能
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414