摘要
硫酸盐还原菌 (SRB) 是一类广泛存在于自然环境中可以利用硫酸盐类物质作为呼吸代谢电子受体的厌氧类微生物,是造成金属腐蚀破坏和设备故障的主要原因之一,已经成为一个重要的研究课题。由于微生物活动的复杂性,生物膜内SRB与金属表面的相互作用缺乏深入的研究,其诱导腐蚀机理和腐蚀过程尚不清楚,难以进行有效的腐蚀预测。基于此,本文从SRB生物膜的呼吸代谢角度介绍了其诱导金属腐蚀的研究进展。介绍了SRB的生态特征和厌氧呼吸过程,重点综述了SRB腐蚀机理,包括阴极去极化、代谢产物腐蚀、浓差电池作用和胞外电子传递等理论,最后简要介绍了微生物腐蚀 (MIC) 研究的方法与技术手段。
关键词: 微生物腐蚀 ; 硫酸盐还原菌 ; 腐蚀机理
腐蚀问题涉及各行各业,已经对人类的生活环境和经济发展产生了严重的危害。根据《中国腐蚀成本》调查结果,2014年我国腐蚀成本超过2.1万亿元人民币,占当年我国国内生产总值 (GDP) 的3.34%[1],腐蚀防护已越来越被各行业各部门所重视。腐蚀防护关系到国家经济发展、自然环境保护和人民健康安全,腐蚀问题在国家经济社会发展过程中已经成为不容忽略的关键问题[2-4]。
微生物腐蚀 (MIC) 是指金属或非金属表面因微生物的生命活动而受到的腐蚀破坏。MIC是油气管道、能源电力等许多行业中导致设施腐蚀失效,甚至造成重大经济损失的一类重要腐蚀[3,4],大约20%或更高的腐蚀损失是由微生物或其代谢活动引起的[5]。微生物在环境中与材料表面相互作用较为复杂,尚无标准的腐蚀模型对其进行预测和评估[6]。
硫酸盐还原菌 (SRB) 属于原核微生物,它们可以利用硫酸盐作为末端电子受体进行呼吸代谢 (异化硫酸盐还原)。SRB不仅局限于细菌,研究认为一些古菌也具有硫酸盐还原功能[7]。目前已经进行了数十种SRB的研究,包括Desulfovibrio,Desulfomicrobium,Desulfobacter和Desulfotomaculum等,有些SRB甚至能够进行有氧呼吸,但这个过程不能维持生长[8],SRB不仅是缺氧环境中发生MIC的重要原因,其代谢过程在全球硫循环中也起到重要作用,具有重要的生态功能。
研究SRB腐蚀微生物的生理代谢过程,并揭示其对海洋工程材料的腐蚀机理,对微生物腐蚀防护研究有重要参考价值[9-11]。本文介绍了SRB的生态特征和其厌氧呼吸过程,然后介绍了SRB在材料表面生物膜的形成过程,综述了SRB腐蚀机理,从经典的阴极去极化理论到胞外电子传递理论,最后简要介绍了MIC研究的方法与技术手段。
1 SRB的生态和生理特征
1.1 SRB的生态特征
SRB广泛分布在土壤、海水、河水、沉积物等自然环境以及地下管道油气井、港口等设施材料生物膜中,最适宜的生长为pH6~9,温度为20~30 ℃,生长所需的氧化还原电位 (OPR) 一般不高于-150 mV,它们对生长所需的环境有较强的适应性,某些SRB可以在50~60 ℃的高温下存活,同时一些高盐生态环境中也能检测到它们的存在[12]。H2S对SRB的生长存在较大影响,一般认为浓度达到16 mmol/L就会对其生长产生明显抑制效果[13]。在含有硫酸盐的缺氧环境中,SRB通过获取电子将硫酸盐还原为H2S而获得生长所需的能量,该电子通常来源于有机物质或分子氢的利用,分子氢是土壤、沉积物和其他缺氧环境中的常见发酵产物[14]。
通过研究不同地区的土壤SRB分布规律,显示土壤中SRB的含量为10~1800 cell·g-1,土壤类型、温度、气候状况和地理位置等因素都影响着SRB含量的分布[15],纬度较高、年平均温度较低的地区也不利于SRB的生长繁殖[16]。在海洋环境中,SRB广泛存在于各个区域,主要分布在表层海水;随着深度增加,SRB含量呈指数减少。例如,在加利福利亚太平洋表层海水中,SRB可达106 cell·g-1;而在780 m水深处,SRB含量锐减到103 cell·g-1。在近岸港湾、沿岸地区和污水处理厂附近SRB含量较高。据调查,中国山东乳山湾表层海水SRB含量为103~106 cell·g-1,在胶州湾潮间带和沿岸区更可高达107 cell·g-1。SRB含量还呈现一定的季节变化趋势[17]。2007~2008年对象山港海域的表层海水、上层海水和沉积物进行取样,分析SRB丰度的时空分布特征及主要影响因素,其结果显示水样及沉积物中SRB的变化范围为30~2300 cells·mL-1,且沉积物中的SRB含量最高,其丰度与环境关系较大,并且呈现出不均匀的状态,人类活动对于SRB的分布有明显影响[14]。随着研究的深入,结果显示SRB的分布也与有机质污染、营养盐 (NO2-—N、NH4+—N)、pH及温度等因素有关[18]。SRB生态分布特征为实际环境中微生物的分布和代谢研究提供了重要指导。本课题组[19-21]研究了实际海洋环境中金属材料表面微生物群落的附着情况,结果表明不同海域生物群落有较大差异,对于三亚和厦门海域优势属为Bacillus和Vibrio;不同金属材料附着的生物群落也有显著差异,碳钢锈层中硫酸盐还原微生物为主要腐蚀微生物,由外锈层到内锈层的优势菌属分别为Desulfotomaculum、Desulfonatronum和Desulfovibiro。
1.2 SRB的厌氧呼吸
SRB在有机物的降解过程中以硫酸盐 (SO42-) 作为末端电子受体还原产生H2S和CO2,因此,SRB在S和C的生物地球化学循环中起到重要作用,如图1所示[22]。SRB将SO42-还原为H2S后,化能异养微生物可以将这些H2S氧化为单质硫 (S0),并继续氧化为SO42-;同时,大气中的H2S也可以通过氧化和大气沉淀作用形成硫酸盐,继而形成的SO42-又再次被SRB利用还原为H2S;SRB细胞通过有机硫的脱硫基分解作用也释放出H2S,整个过程构成了SRB的硫循环系统。在碳循环中,SRB通过利用有机酸等有机物作为硫酸盐还原过程中的电子供体而产生CO2,进入全球碳循环,CO2又可以通过光合作用和固碳微生物转化为碳水化合物,这些复杂的碳水化合物又通过发酵微生物进一步转化为简单的有机物,从而继续被SRB利用[6]。
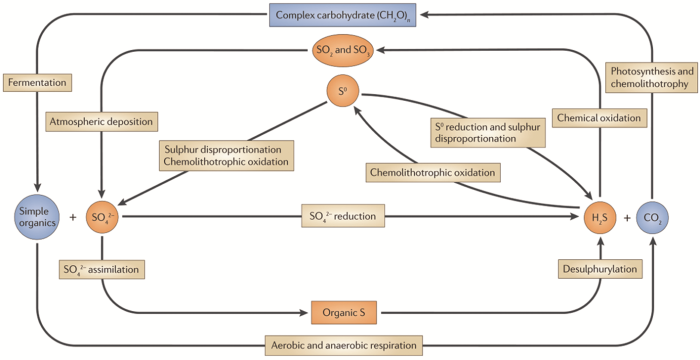
图1 SRB参与的碳循环和硫循环示意图[22]
在生物硫循环过程中,SRB的厌氧呼吸过程如图2所示[22]。有机化合物 (如乳酸) 氧化产生的H+通过SRB内活性Ech (Escherichia coli hydrogenase 3) 和COO (CO-dependent) 两种酶循环到SRB胞质。在胞质中,H2被氢化酶重新氧化为质子和电子,质子为SRB提供了生长所必需的ATP,电子将传递到C型细胞色素 (cytochrome c3),然后继续传递到醌还原酶 (Qrc),再传递到与醌作用的膜结合氧化还原酶 (Qmo),最后传递到硫酸盐还原的腺苷磷酸 (APS) 还原酶。同时,电子还通过未知的机制传递到异化亚硫酸盐还原酶 (Dsr),随后传递到亚硫酸盐 (SO32-) 还原酶。通过这一系列途径,SRB能够获得足够的电子将SO42-完全还原为H2S。同时,胞质中的乳酸会被分解为丙酮酸,进一步分解为甲酸,在甲酸脱氢酶 (Fdh) 的作用下最终分解为H+、CO2和电子,甲酸分解产生的电子和H2分解产生的电子在胞质内具有相同的传递路径[23]。电子传递过程在能量学角度上也是完全可行的[24]。
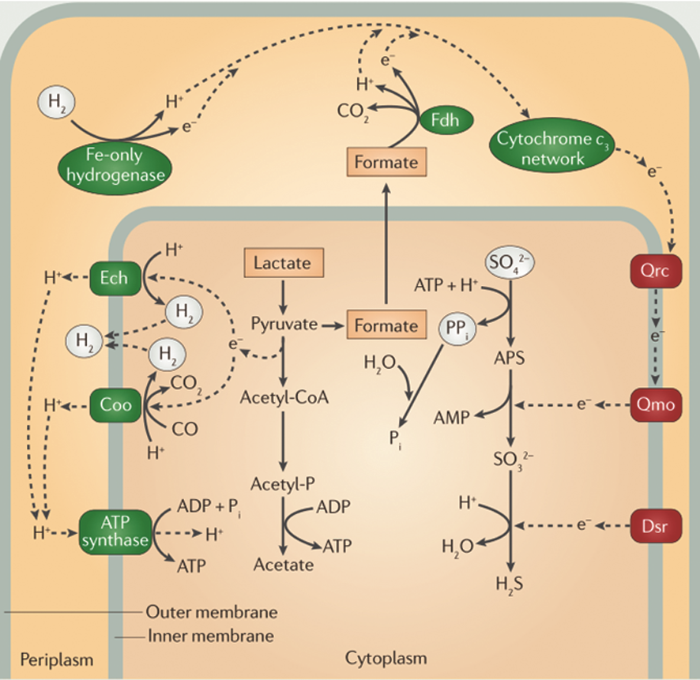
图2 SRB的厌氧呼吸过程[22]
SRB将S和C的生物化学循环结合在一起,其不仅能够将乳酸、丙酮酸、简单芳香族化合物 (苯或苯酚) 作为碳源,甚至能够利用氨基酸或高分子链脂肪酸为其生长代谢提供能量,某些SRB还可以将硝酸盐或分子氢作为替代的呼吸底物[25]。因此,对SRB的生态和厌氧呼吸代谢过程进行研究,对于控制微生物活动和进一步发展生物技术在环境修复、生物污染、能源生产、废水处理和矿物回收等方面有重要意义。
2 SRB的附着和生物膜的形成
微生物在环境中可以以多种方式与材料表面相互作用,这使得MIC系统较为复杂,难以用标准的腐蚀模型评估预测。生物膜的形成使细菌能够与材料表面密切接触,并形成了与本体溶液不同的微环境,包括膜内pH、溶解氧、有机和无机离子等[26]。在各种环境中,微生物90%以上是以生物膜的形式存在,附着微生物群落的组成很可能是由生物膜的调节和材料表面的相互作用决定的。生物膜内包括细胞及其分泌的胞外聚合物 (EPS),其中EPS是由多糖、脂质、核酸、蛋白质等有机和无机物构成,具有一定的强度和黏性,在金属表面有较强的附着性,EPS含有的不同大分子物质在其粘附于材料表面后,为活性酶和氧化还原活性酶的产生提供了理想条件[27]。生物膜在材料表面起到屏障作用,一方面阻止溶液物质向金属表面扩散,另一方面阻止膜内物质向溶液扩散,但是具体阻碍方式有待研究。图3为SRB生物膜在金属表面化学复杂性的示意图及其在MIC中的影响。图中,M为基体金属,M2+为金属离子,e-为电子。生物膜内SRB大量聚集,其代谢产生了大量H+、SO42-和NO3-,然而生物膜阻碍膜内外物质的流通方式尚不明确[28]。
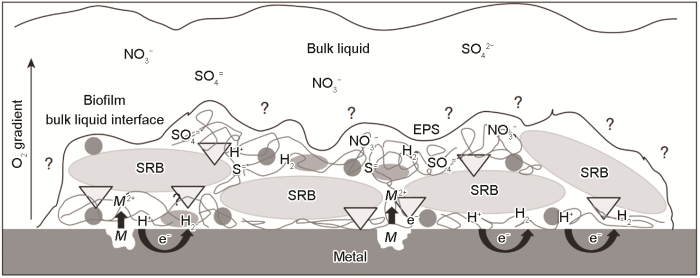
图3 SRB生物膜在金属表面化学复杂性的示意图及其在MIC中的影响[7]
生物膜是精细的三维结构,在具有强大剪切力的系统中,生物膜只有数微米厚;而在液压压力较小的区域,生物膜的厚度可以达到厘米级。在天然海水中,生物膜的厚度为50~150 μm[29]。生物膜的形成和增长过程可以分为6个阶段:(1) 在金属表面形成吸附膜;(2) 浮游微生物在吸附膜的吸引下迁移到材料表面;(3) 浮游微生物附着在材料表面的活性部位,转化为固着微生物;(4) 固着微生物生长并产生代谢产物,形成生物膜;(5) 随着代谢产物和固着微生物的增加,形成成熟稳定的生物膜;(6) 随着时间的推移,生物膜的稳定性降低,部分生物膜脱落,形成异质生物膜[30]。
研究[31-33]表明,生物膜形成的不同时期对腐蚀的影响也不同,最终不稳定生物膜脱落形成的异质生物膜会引起材料的局部腐蚀,加速腐蚀速率。当材料表面出现异质生物膜时,生物膜中致密部位会阻止O2的扩散,生物膜中的好氧细菌也会消耗生物膜内的O2,这两种效应共同作用下会产生低氧浓度的区域,这些区域成为材料腐蚀的阳极。同时,具有较低密度的生物膜或没有生物膜的部位具有较高的氧浓度,成为阴极,在材料表面形成氧浓差电池,引起局部腐蚀。微生物膜的组成和形成过程是一个很复杂的生物化学过程,同时环境因素对生物膜的形成过程影响很大,膜内微生物种群间的相互作用也极为复杂,实验室条件下还不能模拟出自然环境下形成的生物膜[34]。
3 SRB腐蚀研究进展
3.1 氢化酶阴极去极化理论
1934年von Wolzogen等[35]提出了氢化酶阴极去极化理论,阴极去极化理论将这种金属破坏归因于阴极氢的微生物消耗。在没有氧的条件下,金属腐蚀的阴极反应是H+的逸出,但由于H+的过电位太高,腐蚀电池本身难于供给这样的电位,因而阴极被一层H2所覆盖,使得金属腐蚀中止。在SRB存在情况下,其能够从金属表面除去H2,从而使腐蚀过程继续。之后,Booth等[36]证明Desulfovidrio vulgaris可以使低碳钢表面的阴极区域去极化,利用阴极极化的氢还原硫酸盐,促进钢的腐蚀,为阴极去极化理论奠定了基础。
该理论提出后,众多研究者深入研究,并在不断的探索中完善了阴极去极化理论。Muyzer等[37]基于氢化酶阴极去极化理论建立MIC模型,如图4所示。SRB在金属表面吸附后利用体内的氢化酶将SO42-还原成H2S,同时将金属表面阴极上生成的H除去,局部分压降低,并且通过这种“去极化”作用使得Fe溶解,反应如 (1)~(7) 式:
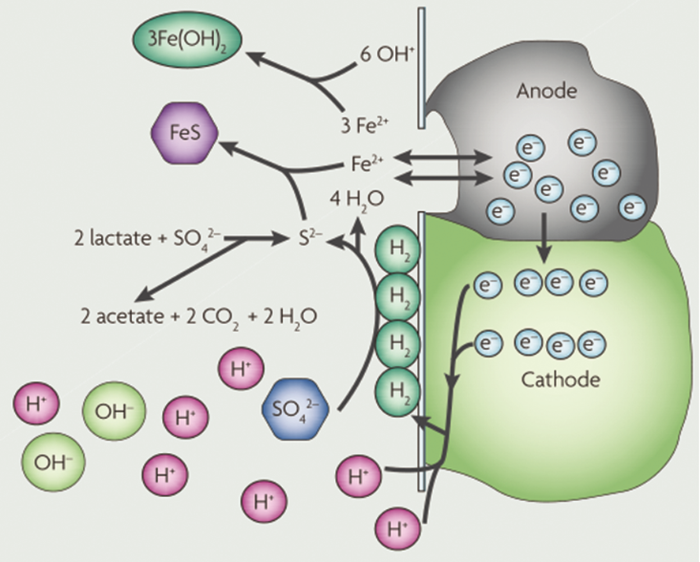
图4 氢化酶阴极去极化机理图[36]
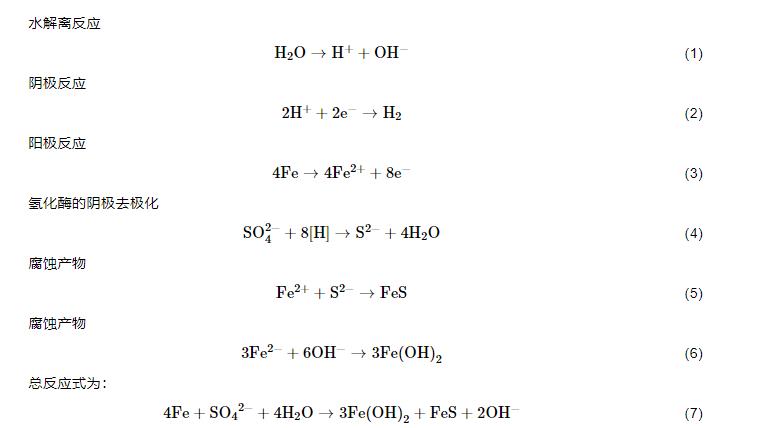
近几年,阴极去极化理论不断完善。大多数研究者认为扩散溶解的H2进入SRB细胞后,最终到达细胞质膜,在氢化酶的生物催化作用下被利用,膜结合的氢化酶和多血红细胞色素通过黄素氧化还原蛋白 (或其他电子载体) 将电子传递到APS,使细胞质中的硫酸盐还原。实验室封闭环境模拟SRB腐蚀行为的研究显示,随着金属材料腐蚀时间的延长,其腐蚀速率和EPS中蛋白质数量显著增加,这可能与SRB细胞内的氢化酶有关,材料表面溶解的Fe增加了氢化酶的合成,更多的氢化酶合成增加了细菌的代谢活性,从而加速腐蚀[38],da Silva等[39]的研究也有相似结果。通过计时安培法和循环伏安法研究D. desulfuricans 27774对不锈钢和石墨电极表面生物膜的电活性影响,结果显示,氢化酶与不锈钢和石墨表面存在电子通道,可以进行直接电子转移,推测电子通道也可以让营养物质和O2扩散,形成浓度梯度[40],Yu等[10]研究表明,实验室石墨电极表面形成SRB能够催化氢的氧化还原,推测氢化酶在电子传递过程中具有重要作用。Cu2+和Ag+对Desulfovibrio sp.细菌的影响研究表明,表面生物膜元素成分分析表明S峰值很高,这可能是在氢化酶的作用下形成了非均匀的FeS腐蚀产物膜,对材料起到一定保护作用[41]。同时,研究者根据阴极去极化理论研发了一套点蚀预测系统,利用计算机仿真研究SRB的腐蚀过程[42]。
氢化酶还同时起到了能量调节的作用。当碳源缺乏时,氢化酶可以增强SRB的还原硫酸盐能力;当碳源不可用时,氢化酶可以促进SRB直接获取电子,这些代谢途径研究对MIC的认识有重要意义。在未来研究中,深入认识氢化酶在MIC中的作用对于生物能源和生物技术的利用也具有重要意义[43,44]。
3.2 代谢产物腐蚀理论
微生物分泌的腐蚀性代谢物质引起的MIC可以称为代谢产物腐蚀 (M-MIC),如图5所示[45]。腐蚀性代谢物质包括H+、有机酸和硫化物等氧化剂。研究[46]表明,生物膜中产酸菌 (APB) 分泌的有机酸、SRB排出的H2S均能加速腐蚀。M-MIC本质是一个电化学腐蚀过程,Fe氧化和H+还原是两个可分离的电极反应。除了SRB和APB等细菌外,真菌 (如黑曲霉) 也会分泌酸性代谢物,从而引起M-MIC。
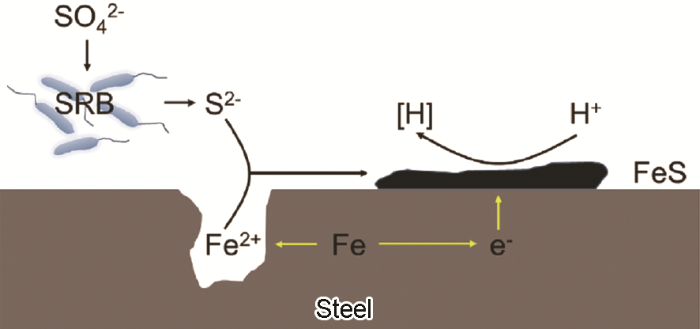
图5 FeS代谢产物腐蚀机理图[45]
SRB对铜合金的腐蚀研究结果显示,由于硫酸盐还原电位低于Cu+/Cu和Cu2+/Cu电位,Cu不能给SRB的硫酸盐还原过程提供足够的能量,因此SRB对Cu的腐蚀是由SRB代谢产生的硫化物引起,直接证明了铜合金腐蚀是由M-MIC造成的[47]。同时,通过控制溶液环境中硫化物含量也证明了D. vulgaris对Cu的腐蚀方式为M-MIC[48]。研究者改变培养体系中SRB代谢产生的H2S含量,研究H2S对SRB生长代谢和碳钢腐蚀的影响。结果显示,培养体系中气体剩余体积越大,SRB代谢产生的H2S越多,溶液中溶解的H2S更少,浮游细菌和材料表面附着细菌的数量均增加,导致MIC更严重[49]。
介质中Fe2+和Fe3+浓度是影响M-MIC的一个重要因素,研究人员开展了大量工作研究Fe2+对SRB和FeS薄膜影响[50]。刘宏芳等[51]研究表明,介质中不同浓度的Fe2+在碳钢表面形成的FeS腐蚀产物膜不同,对碳钢的腐蚀影响差异较大。更多的研究[52]表明,低碳钢的腐蚀速率与溶液介质中的Fe2+浓度成正比,Fe2+的存在改变了FeS膜的类型,Fe2+含量的增加会导致FeS膜的断裂,从而增加腐蚀速率。关于Fe2+和Fe3+对SRB腐蚀的影响,人们提出了许多猜测,包括Fe/FeS引起电偶腐蚀、阴极去极化影响、氢化酶调节和FeS薄膜物理性质的变化。Fe2+和Fe3+在SRB细胞内起到什么作用以及对FeS膜的形成有什么影响还需要进一步研究。
H2S的含量对SRB代谢产物也有重要影响。生物膜中SRB的数量可以达到108 cell·cm-2,其产生的腐蚀性H2S会引起膜内局部pH降低,造成严重局部腐蚀[53],同时,SRB代谢产生的硫化物会减弱金属键在材料表面的结合力,导致金属的阳极溶解速率增加[54]。Desulfovibrio sp.细菌对316L不锈钢的腐蚀研究结果表明,该细菌能有效利用H2,但在给定电位下316L自腐蚀电位和腐蚀电流密度不变,材料表面沉积的FeS对阴极反应没有明显的催化作用,因此H2消耗不是微生物腐蚀的决定性因素,而FeS作为一种半导体薄膜会影响电子从金属移动到细胞,在厌氧腐蚀中发挥着重要作用[55]。Iverson[56]综述了厌氧腐蚀机理,认为材料腐蚀速率与Fe2+和H2S有关,Fe2+和H2S反应使基体表面形成铁硫化合物的薄膜,从而使细菌与基体表面不直接接触,其腐蚀速率增加。
生物膜中M-MIC过程会产生少量的H2,这部分H2被认为是含有氢化酶微生物的能量来源,目前尚不清楚M-MIC过程产生的代谢产物是不是其他微生物的能量来源,未来还需要进一步进行相关实验论证。
3.3 浓差电池作用理论
1958年,Starkey[57]首先提出浓差电池理论,即金属材料表面被腐蚀产物或者其它污垢覆盖时,在材料表面与介质的界面处会形成浓差电池。1964年,King等[58]研究表明,FeS沉积在材料表面形成的浓差电池是金属腐蚀的原因。
之后的研究进一步表明浓差电池的形成与生物膜的结构和形成有关[59]。材料在海洋和油气环境下形成的生物膜,膜内含有大量的好氧菌,好氧菌在生物膜内分布不均匀,通过呼吸作用消耗了生物膜内的O2,使得这些区域O2浓度较低成为阳极区,而生物膜密度较小或没有生物膜覆盖的区域具有较高的氧浓度成为阴极区。由于氧浓度差异而引起的局部腐蚀过程称为氧浓差电池,如图6所示[6]。Skovhus等[9]综述了油气管道MIC机理,生物膜内固体有机和无机颗粒沉降在管道表面时会形成不同电偶电位区域,引起浓差电池腐蚀。因此,生物膜的研究对于浓差电池的作用机理认识至关重要。
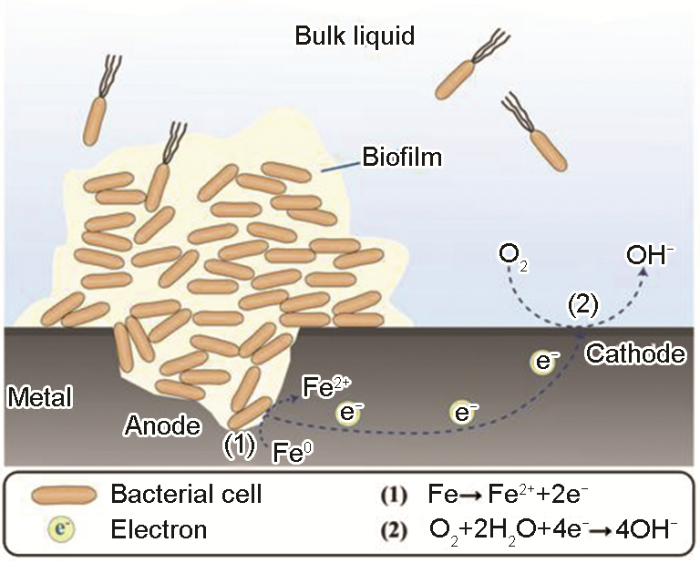
图6 生物膜内氧浓差电池点腐蚀机理图[6]
近几年,研究人员在MIC方面进行了大量研究工作,浓差电池作用机理也较为完善。研究者[60]进行了低合金钢在海水中的氧浓差电池腐蚀行为研究,将低合金钢的耐蚀性分为3类,之后进一步研究了低合金钢中不同元素形成的氧浓差电池差异。对涠洲油田套管断裂事件的原因分析,认为该事件是由于隔水管泄漏,使得套管与海水直接接触,在海平面处形成了宏观氧浓差电池导致套管腐蚀断裂失效[61]。通过电化学和表面分析方法研究SRB对钢的腐蚀影响,可见随着培养时间的增加,SRB的腐蚀电位升高,由于溶液中形成了FeS,培养基颜色由灰色变为黑色,钢在SRB中的腐蚀速率增加,可能是因为其阴极反应速率增加使硫酸盐还原为硫化物的速率增快从而形成了浓差电池[62]。Moon等[63]在之后的研究进一步表明,SRB存在下的阴极反应加速的同时也提高了阳极反应速率和腐蚀速率,SRB生物膜内形成了氧浓差电池,并引起了严重的点蚀。
3.4 胞外电子传递理论
研究[64-66]表明,微生物能直接从金属表面获取电子,加速金属的溶解。Dinh等[67]以金属Fe作为唯一电子供体从海洋中分离培养得到一株新型腐蚀性SRB,通过测量其产生的硫化物、CH4、H2等代谢产物,显示能够直接从金属Fe中获得电子的新型SRB比传统的SRB硫酸盐还原得更快。经典的阴极去极化理论明显不能解释这类细菌的腐蚀行为,细胞外电子传递 (EET) 理论的提出,很好地解释了这类细菌的腐蚀机理[68,69]。胞外电子传递依赖于生物膜的形成,电子与离子不同,电子不能在液体中独立存在,而生物膜内电子载体较多,更有利于浮游细菌的利用。近年来许多研究者研究了SRB和硝酸盐还原菌 (NRB) 在MIC中的跨膜电子传递机理,进一步完善了该理论[7]。
胞外电子传递有两种方式,如图7所示[69],包括直接电子传递 (DET) 和电子载体电子传递 (MET)。直接电子传递包括两种方式:(1) 依赖于外膜结合的氧化还原活性蛋白与基体导体表面直接接触,如C型细胞色素;(2) 依赖于导电菌毛 (导电纳米线) 与导体表面接触。电子载体电子传递需要利用可溶性电子载体物质,如H+/H2、核黄素和黄素腺嘌呤二核苷酸 (FAD) 等氧化还原活性物质。对于MIC中的胞外电子传递,电子通过DET或MET两种方式传递到与细胞外膜结合的氧化还原蛋白处,电子进入细胞后,细胞内的电子传输链 (ETC) 通过一系列的氧化还原反应将电子传递到细胞质中的末端电子受体[70],即SRB厌氧呼吸中的硫酸盐。对于细菌,ETC也依赖于各种与细胞质膜结合的氧化还原活性物质,如细胞色素和核黄素类,研究表明这类氧化还原活性物质作为电子媒介会加速碳钢和不锈钢的SRB腐蚀[68]。
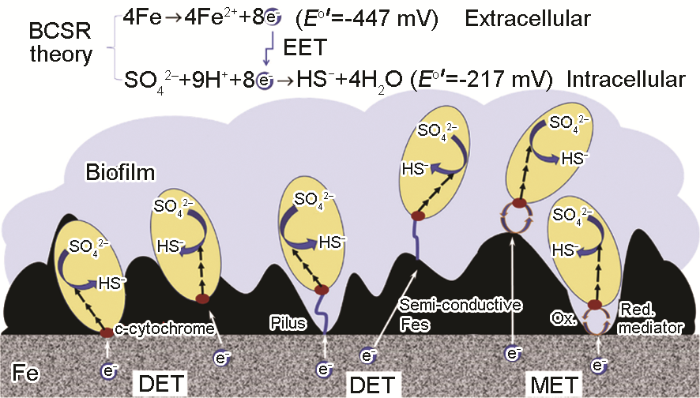
图7 SRB 从金属到细胞表面电子传递的3种方法[69]
依赖于外膜结合的氧化还原活性蛋白进行的DET已经成为了研究热点。对D. Corrodens strain IS4典型腐蚀SRB的研究表明,从电极上获取电子并不局限于铁作为微生物代谢的唯一电子供体,细菌也能够在石墨和掺杂锗的阴极上获取电子,同时通过红外光谱电化学方法,认为C型细胞色素是与外膜相关的氧化还原活性成分并且直接参与IS4细菌从基体表面直接获取电子[8],具有这种功能的微生物可以称为电营养微生物[19]。但是,氧化还原活性蛋白对电子的吸收也存在争议。研究者对SRB存在下管线钢涂层的电化学腐蚀研究表明,必须具有足够的负电荷SRB自身蛋白才能直接摄取电子[71]。未来应用生物学等技术手段分离具有氧化还原活性成分的细菌细胞外膜,进行功能分析,将有助于研究外膜细胞色素在整个DET过程中的作用,从而具体描述电子通过氧化还原活性蛋白在整个细胞中的传递过程。
依赖于导电菌毛 (纳米线) 进行的DET也已进行了大量研究[69]。研究者[72]认为在没有有机碳源的培养基中,SRB细胞表面会出现大量菌毛附着在Fe表面,而在培养基中加入有机碳培养源,则未观察到这些菌毛[73],进一步研究显示SRB细胞利用这些菌毛从碳钢表面直接获取电子进行硫酸盐还原从而在碳源缺乏环境中存活。Reguera等[74]的研究也显示Geobacter sulfurreducens细菌菌毛缺失的突变体不能还原铁 (III) 氧化物,但能吸附在铁氧化物表面,电子探针原子力显微镜也显示该菌毛具有良好的导电性。这些研究表明,SRB细胞的菌毛可以作为生物纳米线,将电子从细胞表面转移到铁 (III) 氧化物表面。除了作为电子转移通道,菌毛还可以参与其他电子转移反应,例如,单个SRB的菌毛经常交织在一起从而增加菌毛间细胞电子转移的可能性[75]。该理论为独特的细胞表面和细胞间相互作用提出了新的解释,也为新型导电材料的研究提供了可能性。通过进一步理论研究,这类细菌制造的纳米线在纳米电子和基因修饰方面将有很大的应用前景。
研究者对MET方式进行的胞外电子传递进行了初步探究[6]。核黄素和黄素腺嘌呤二核苷酸 (FAD) 两种电子传递介质对Pseudomonas aeruginosa生物膜和碳钢的腐蚀影响研究表明,两种电子传递介质对碳钢腐蚀有明显的促进作用且碳钢表面点蚀坑更深,而溶液中浮游细菌没有太大变化[76]。Zhang等[77]用同样方法证明电子传递介质会增加304不锈钢的点蚀和失重。目前对电子载体传递机理的研究仍相对较少,电子传递介质在整个电子转移过程中的作用还需要进一步研究。
胞外电子传递相关基因研究,可以阐明电子传递在MIC中的重要性。Huang等[78]对P. aeruginosa内合成内源性电子介质吩嗪-1-甲酰胺的PhzH基因进行敲除,结果证明,PhzH的缺失降低了2205双相不锈钢的腐蚀速率,而在敲除的P. aeruginosa中恢复了该基因,腐蚀速率基本恢复。从分子和遗传水平上阐明SRB中的胞外电子传递的机制,有助于证明EET和MIC的相互关系,还需要进一步的研究和更多的证据。
胞外电子传递机理的研究对腐蚀保护应用有重要意义[14]。通常使用外加电流阴极保护 (ICCP) 作为一种常用的抑制微生物腐蚀的方法,但电营养微生物存在时,该方法的使用会为微生物代谢提供电子,促进Desulfovibrio这类SRB和其他电营养微生物在阴极保护设施周围繁殖代谢,造成ICCP系统失效,使材料设施暴露在富含硫化物的沉积物和腐蚀性微生物群落中。已有研究[79,80]显示,SRB存在下,在0.85 V (vs SCE) 阴极保护电位 (CP) 下,EQ70高强度钢的腐蚀速率高于无CP的,而在-1.05 V (vs SCE) 下,EQ70的腐蚀速率低于无CP的,SRB在0.85 V (vs SCE) 时代谢活性增强很可能是由极化电极的直接电子传递引起。
随着MIC研究的进展,研究人员[9,81]进一步提出了生物催化阴极硫酸盐还原 (BCSR) 理论,从生物能量学和生物电化学的角度进一步地解释了MIC的作用机理[81,82]。对于SRB引起的MIC,乳酸等脂肪酸通常作为其生长的有机碳源和电子供体,硫酸盐作为末端电子受体完成氧化还原反应过程。在BCSR理论中,当SRB在铁表面形成生物膜时,由于受到扩散和顶层生物膜对碳源消耗的限制,碳源很难到达贴近金属表面的SRB生物膜,靠近金属表面的固着SRB基本没有能够利用的碳源,此时饥饿的SRB将使用易被腐蚀的金属 (如Fe) 作为电子供体从而获取其生长代谢所需的能量。图8为有机碳-硫酸盐还原和以Fe为电子供体的BCSR之间的差异[83]。因此,BCSR理论回答了当生物膜中碳源缺乏时,微生物腐蚀金属的目的是从这个过程中获得能量来维持它们的生长代谢。
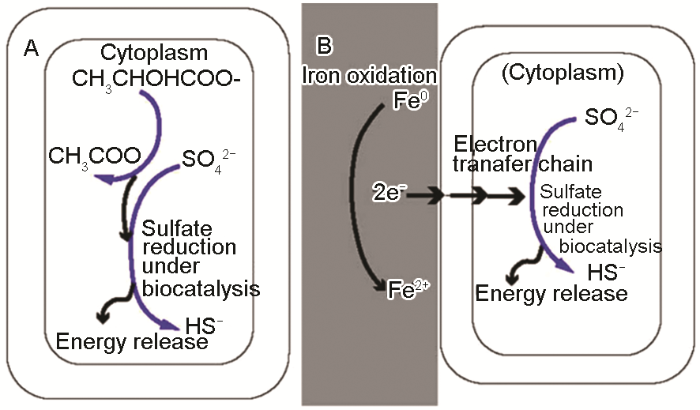
图8 有机碳-硫酸盐反应和BCSR中SRB以铁为电子供体的腐蚀示意图[83]
当Fe被SRB腐蚀时,SRB外部发生金属铁的氧化,而硫酸盐还原发生在SRB内部。因此,Fe氧化释放出的电子将穿过SRB的细胞壁,最终达到其细胞质内发生硫酸盐还原反应的位置。细胞外电子传递到细胞内部方式为胞外电子传递,包括DET和MET机制。该理论很好地解释了微生物为什么和怎样腐蚀金属,是研究MIC的新方法和思路。未来还需要进一步跟踪电子在细胞内外的传递途径,进一步解释腐蚀产物的形成过程和变化原因。
4 MIC研究方法与技术手段
MIC涉及材料 (冶金)、微生物和电化学多学科交叉,需要运用到电化学方法、表面分析方法、微生物学和分子生物学等多种技术手段进行研究。
由于生物腐蚀基本上是一个电化学过程,生物膜的三维结构和其化学成分都会随着时间而改变,因此电化学方法常被应用于微生物腐蚀的监测和机理研究[84-86]。研究[87]表明传统电化学技术 (包括动电位极化曲线法、LPR和EIS) 由于外部施加的电场会导致部分细菌的损伤和死亡,减低微生物活性。Zhao等[87]比较了Pseudomonas aeruginosa存在下不同电化学技术对2205不锈钢连续腐蚀监测后生物膜的影响情况,认为EIS和LPR监测会抑制细菌生长并显著降低生物膜厚度和腐蚀性,导致腐蚀速率和点蚀坑深度明显降低。而新型电化学技术——电化学噪声法不需要对体系施加剧烈扰动,不会对微生物的生长繁殖产生干扰,对生物膜的影响和材料腐蚀影响很小,从而获得最接近的腐蚀速率和点蚀坑深度。新型电化学技术包括微区电化学法、扫描电化学显微镜技术、电化学噪声法等。Zhou等[88]使用电化学噪声法研究了Pseudomonas aeruginosa在2205不锈钢表面的点蚀瞬时形成过程,证明了细胞外电子传递机理。因此,新型电化学技术可以对亚稳态点蚀、稳态点蚀和离子溶解等过程进行快速、小时间尺度的原位表征分析,在不影响微生物活性的同时,可以获得更多的电化学反应界面动力学信息,对于MIC研究有很重要的帮助。
表面分析技术是腐蚀研究的重要方法,对微生物腐蚀研究具有重要意义。表面分析技术包括扫描电镜-能谱仪 (SEM-EDS)、原子力显微镜 (AFM)、X射线光电子能谱分析 (XPS)、飞行时间二次离子质谱 (ToF-SIMS) 和激光扫描共聚焦显微镜 (CLSM) 等。每一种表面分析技术都有其独特的优点和局限性,对样品的处理也各不相同,只有充分认识每一种分析技术,才能更好地发挥其优点。已经有大量文献进行了微生物对材料表界面的研究[89-91],对微生物产生的代谢产物或生物分子 (如酶、糖等) 进行了定性和定量的研究分析,这对微生物腐蚀机理的认识起到了关键作用。随着腐蚀研究的深入,对表面分析技术的精度等各方面要求也更高。El Menjra等[92]利用ToF-SIMS技术研究了Fe表面生成铁硫化物的来源,通过计算铁硫化层中硫同位素的分馏值,可以区分生物和非生物形成的硫化物,有助于更好地研究含硫环境中铁表面非生物或生物形成的铁硫化物过程及其相互作用。多种表面分析技术的结合使用也是未来腐蚀研究发展的趋势,Li等[93]采用聚焦离子束扫描电子显微镜 (FIB-SEM) 研究了SRB在生物膜中的分布情况和基体表面点蚀的纵向元素分布,研究表明生物膜具有一定的阴离子选择性并提出了MIC点蚀机理。因此,更加精确的原位表面分析技术对MIC研究有重要意义。
微生物学或生物化学方法是MIC研究的基础。微生物的培养对MIC研究十分重要,培养基的选择改良对体系微生物的生长代谢有较大影响。世界上现有的大约95%的微生物还不能培养。此外,不同微生物的培养时间不同,从24 h到几周不等,具体取决于样品的种类和体系配比[94,95]。因此,进行微生物腐蚀研究时对于微生物的选择与培养应该十分重视。
分子生物学方法是MIC研究的新趋势。随着分子生物学技术的发展普及和研究成本的降低,生物腐蚀研究中对微生物群落的DNA/RNA/蛋白质的研究开始增加。分子生物学不受培养的限制,可以通过保守的核糖体基因 (16S rDNA或23S rDNA) 研究微生物群落对腐蚀的影响,可以通过RNA或蛋白质研究微生物的代谢活性,也可以通过研究生物腐蚀过程相关的功能基因 (如APS还原酶基因apsA) 从而研究电子在细胞内传递途径[96-98]。Smith等[50]开展了近岸低海水腐蚀区的SRB腐蚀行为研究,采用宏基因组方法研究了细菌体内硫循环过程。Palacios等[99]采用16S sRNA方法研究了Sporomusa和Methanosarcina两种细菌共存下的电子传递机制。因此,分子微生物学的研究方法可能会成为未来微生物腐蚀机理研究的热点。
在进行MIC研究时必须注意样品的采集和保存过程;进行SRB腐蚀研究时,一些测试要求样品在低温甚至在缺氧环境中保存,以防止某些化合物表面在环境中氧化。MIC是一门交叉学科,多种研究手段的交叉使用也是为了更好地研究腐蚀,但是这对研究者也极具挑战[100-102]。
5 总结
微生物腐蚀研究已经有100多年历史,针对SRB腐蚀机理也进行了多年研究,采用电化学、材料学和微生物学的方法,已提出了阴极去极化等多种经典的腐蚀机理,近年来由于微区电化学和分子生物学等方法引入MIC研究中,从生物能量学和生物电化学角度提出了胞外电子传递理论。当溶液环境中有充足的碳源 (如乳酸) 时,SRB优先利用有机物质作为电子供体,而由于受到扩散和顶层生物膜对碳源消耗限制,碳源很难到达贴近金属表面的SRB生物膜,易被腐蚀的金属 (例如Fe) 成为唯一电子供体,此时金属表面SRB会通过胞外电子传递方式获得金属电子。胞外电子传递方式包括氧化还原活性蛋白、细菌纳米线和可溶性电子载体3种方式,从而引起金属材料腐蚀。未来还需要进一步跟踪电子在细胞内外的传递路径,通过基因工程等方法抑制某些特定基因或蛋白酶的表达,探究腐蚀过程中的电子传递载体,并结合多种研究方法以进一步研究SRB腐蚀机理。
参考文献
1 Hou B R, et al. The Cost of Corrosion in China [M]. Beijing: Science Press, 2017
1 侯保荣等. 中国腐蚀成本 [M]. 北京: 科学出版社, 2017
2 Bhandari J, Khan F, Abbassi R, et al. Modelling of pitting corrosion in marine and offshore steel structures-A technical review [J]. J. Loss Prevent. Proc. Ind., 2015, 37: 39
3 Luo P, Zhang Y N, Cai P P, et al. Analysis and countermeasures of natural gas transmission pipeline internal corrosion accidents [J]. Total Corros. Control, 2010, 24(6): 16
3 罗鹏, 张一玲, 蔡陪陪等. 长输天然气管道内腐蚀事故调查分析与对策 [J]. 全面腐蚀控制, 2010, 24(6): 16
4 Hou B R, Zhang D, Wang P. Marine corrosion and protection: Current status and prospect [J]. Bull. Chin. Acad. Sci., 2016, 31: 1326
4 侯保荣, 张盾, 王鹏. 海洋腐蚀防护的现状与未来 [J]. 中国科学院院刊, 2016, 31: 1326
5 Yin Y S, Dong L H, Liu T, et al. Microbial Adhesion Corrosion of Marine Materials [M]. Beijing: Science Press, 2012
5 尹衍升, 董丽华, 刘涛等. 海洋材料的微生物附着腐蚀 [M]. 北京: 科学出版社, 2012
6 Jia R, Unsal T, Xu D K, et al. Microbiologically influenced corrosion and current mitigation strategies: A state of the art review [J]. Int. Biodeterior. Biodegrad., 2019, 137: 42
7 Dall'Agnol L T, Moura J J. Sulphate reducing bacteria (SRB) and biocorrosion [A].
7 Liengen T, Basséguy R, Féron D, et al. Understanding Biocorrosion: Fundamentals and Applications [M]. Oxford: Woodhead Publishing, 2014: 121
8 Beese-Vasbender P F, Nayak S, Erbe A, et al. Electrochemical characterization of direct electron uptake in electrical microbially influenced corrosion of iron by the lithoautotrophic SRB Desulfopila corrodens strain IS4 [J]. Electrochim. Acta, 2015, 167: 321
9 Xia J, Xu D K, Nan L, et al. Study on mechanisms of microbiologically influenced corrision of metal from the perspective of bio-electrochemistry and bio-energetics [J]. China J. Mater. Res., 2016, 30: 161
9 夏进, 徐大可, 南黎等. 从生物能量学和生物电化学角度研究金属微生物腐蚀的机理 [J]. 材料研究学报, 2016, 30: 161
10 Yu L, Duan J, Du X, et al. Accelerated anaerobic corrosion of electroactive sulfate-reducing bacteria by electrochemical impedance spectroscopy and chronoamperometry [J]. Electrochem. Commun., 2013, 26: 101
11 Zhang Y M, Zheng Z X, Duan J Z. Relationship between hydrocarbon degradation and biocorrosionin marine environment [J]. Surf. Technol., 2019, 48(7): 211
11 张一梦, 郑泽旭, 段继周. 海洋中石油烃类降解与微生物腐蚀关系研究 [J]. 表面技术, 2019, 48(7): 211
12 Zhang X L, Chen Z X, Liu H H, et al. Effect of environment factors on the growth of sulfate-reducing bacteria [J]. J. Chin. Soc. Corros. Prot., 2000, 20: 224
12 张小里, 陈志昕, 刘海洪等. 环境因素对硫酸盐还原菌生长的影响 [J]. 中国腐蚀与防护学报, 2000, 20: 224
13 Stott J F D, Herbert B N. The effect of pressure and temperature on sulphate-reducing bacteria and the action of biocides in oilfield water injection systems [J]. J. Appl. Bacteriol., 1986, 61: 57
14 Dec W, Mosia?ek M, Socha R P, et al. The effect of sulphate-reducing bacteria biofilm on passivity and development of pitting on 2205 duplex stainless steel [J]. Electrochim. Acta, 2016, 212: 225
15 Jiang B, Gong A J, Li X G, et al. The distribution laws of sulfate-reducing bacteria in eight soil corrosion test stations in China [J]. Chem. Bioeng., 2008, 25(4): 54
15 蒋波, 弓爱君, 李晓刚等. 硫酸盐还原菌在8个土壤试验站中的分布规律研究 [J]. 化学与生物工程, 2008, 25(4): 54
16 Wang H L, Yang J F. Spatiotemporal distribution of sulfate-reducing bacteria in Xiangshan Bay and related affecting factors [J]. Chin. J. Ecol., 2011, 30: 2857
16 王海丽, 杨季芳. 象山港海域硫酸盐还原菌的时空分布及其影响因素 [J]. 生态学杂志, 2011, 30: 2857
17 Chen H W. Economic importance of marine sulfate-reducing bacteria and their activities [J]. J. Oceanogr. Huanghai Bohai Seas, 1998, 16(4): 65
17 陈皓文. 海洋硫酸盐还原菌及其活动的经济重要性 [J]. 黄渤海海洋学报, 1998, 16(4): 65
18 Schoeffler M, Gaudin A L, Ramel F, et al. Growth of an anaerobic sulfate-reducing bacterium sustained by oxygen respiratory energy conservation after O2-driven experimental evolution [J]. Environ. Microbiol., 2019, 21: 360
19 Duan J Z, Wu S R, Zhang X J, et al. Corrosion of carbon steel influenced by anaerobic biofilm in natural seawater [J]. Electrochim. Acta, 2008, 54: 22
20 Li X H, Xiao H, Zhang W J, et al. Analysis of cultivable aerobic bacterial community composition and screening for facultative sulfate-reducing bacteria in marine corrosive steel [J]. J. Oceanol. Limnol., 2019, 37: 600
21 Zhang Y M, Ma Y, Duan J Z, et al. Analysis of marine microbial communities colonizing various metallic materials and rust layers [J]. Biofouling, 2019, 35: 429
22 Zhou J H, He Q, Hemme C L, et al. How sulphate-reducing microorganisms cope with stress: lessons from systems biology [J]. Nat. Rev. Microbiol., 2011, 9: 452
23 Liu Y, Bond D R. Long‐distance electron transfer by G. sulfurreducens biofilms results in accumulation of reduced c-type cytochromes [J]. ChemSusChem, 2012, 5: 1047
24 Kato S. Microbial extracellular electron transfer and its relevance to iron corrosion [J]. Microb. Biotechnol., 2016, 9(2): 141
25 Da Silva J J R F, Williams R J P. The Biological Chemistry of the Elements: The Inorganic Chemistry of Life [M]. 2nd Ed. Oxford: Oxford University Press, 2001
26 Liu H W, Xu D K, Wu Y N, et al. Research progress in corrosion of steels induced by sulfate reducing bacteria [J]. Corros. Sci. Prot. Technol., 2015, 27: 409
26 刘宏伟, 徐大可, 吴亚楠等. 微生物生物膜下的钢铁材料腐蚀研究进展 [J]. 腐蚀科学与防护技术, 2015, 27: 409
27 Liu H W, Fu C Y, Gu T Y, et al. Corrosion behavior of carbon steel in the presence of sulfate reducing bacteria and iron oxidizing bacteria cultured in oilfield produced water [J]. Corros. Sci., 2015, 100: 484
28 Flemming H C, Neu T R, Wozniak D J. The EPS matrix: The “house of biofilm cells” [J]. J. Bacteriol., 2007, 189: 7945
29 Jia R, Yang D Q, Xu D K, et al. Anaerobic corrosion of 304 stainless steel caused by the Pseudomonas aeruginosa biofilm [J]. Front. Microbiol., 2017, 8: 2335
30 Duan J Z, Liu C, Liu H L, et al. Research progress of biofouling and its control technology in marine underwater facilities [J]. Mar. Sci., 2020, 44(8): 162
30 段继周, 刘超, 刘会莲等. 海洋水下设施生物污损及其控制技术研究进展 [J]. 海洋科学, 2020, 44(8): 162
31 Zhuang L, Tang Z Y, Ma J L, et al. Enhanced anaerobic biodegradation of benzoate under sulfate-reducing conditions with conductive iron-oxides in sediment of Pearl river estuary [J]. Front. Microbiol., 2019, 10: 374
32 Chen Y, Gu G D, Zhu G, et al. Separation of oilfield sulfate reducing bacteria identification and growth characteristics research [J]. Chem. Eng., 2015, 29(5): 50
32 陈颖, 谷国栋, 朱葛等. 油田硫酸盐还原菌的分离鉴定及生长特性研究 [J]. 化学工程师, 2015, 29(5): 50
33 Xing M N, Wei Y F, Zhou Y, et al. Radical-mediated C-S bond cleavage in C2 sulfonate degradation by anaerobic bacteria [J]. Nat. Commun., 2019, 10: 1609
34 Little B, Ray R. A perspective on corrosion inhibition by biofilms [J]. Corrosion, 2002, 58: 424
35 von Wolzogen K C A H, van der Vlugt I S. The graphitization of cast iron as an electrochemical process in anaerobic soils [J]. Water, 1934, 18: 147
36 Booth G H, Tiller A K. Cathodic characteristics of mild steel in suspensions of sulphate-reducing bacteria [J]. Corros. Sci., 1968, 8: 583
37 Muyzer G, Stams A J M. The ecology and biotechnology of sulphate-reducing bacteria [J]. Nat. Rev. Microbiol., 2008, 6: 441
38 Alkan A, Gümü? S, Atapek ? H, et al. A case study of a stress corrosion cracking failure in an AA5083 mold material used for curing rubber compounds [J]. Prot. Met. Phys. Chem. Surf., 2016, 52: 1100
39 da Silva M L B, Soares H M, Furigo A, et al. Effects of nitrate injection on microbial enhanced oil recovery and oilfield reservoir souring [J]. Appl. Biochem. Biotechnol., 2014, 174: 1810
40 Cordas C M, Guerra L T, Xavier C, et al. Electroactive biofilms of sulphate reducing bacteria [J]. Electrochim. Acta, 2008, 54: 29
41 Unsal T, Ilhan-Sungur E, Arkan S, et al. Effects of Ag and Cu ions on the microbial corrosion of 316L stainless steel in the presence of Desulfovibrio sp. [J]. Bioelectrochemistry, 2016, 110: 91
42 Xu D K, Li Y C, Gu T Y. Mechanistic modeling of biocorrosion caused by biofilms of sulfate reducing bacteria and acid producing bacteria [J]. Bioelectrochemistry, 2016, 110: 52
43 Moradi M, Duan J Z, Du X Q. Investigation of the effect of 4, 5-dichloro-2-n-octyl-4-isothiazolin-3-one inhibition on the corrosion of carbon steel in Bacillus sp. inoculated artificial seawater [J]. Corros. Sci., 2013, 69: 338
44 Wu T Q, Yan M C, Yu L B, et al. Stress corrosion of pipeline steel under disbonded coating in a SRB-containing environment [J]. Corros. Sci., 2019, 157: 518
45 Voordouw G, Niviere V, Ferris F G, et al. Distribution of hydrogenase genes in Desulfovibrio spp. and their use in identification of species from the oil field environment [J]. Appl. Environ. Microbiol., 1990, 56: 3748
46 Enning D, Garrelfs J. Corrosion of iron by sulfate-reducing bacteria: new views of an old problem [J]. Appl. Environ. Microbiol., 2014, 80: 1226
47 Fu W J, Li Y C, Xu D K, et al. Comparing two different types of anaerobic copper biocorrosion by sulfate- and nitrate-reducing bacteria [J]. Mater. Perform., 2014, 53: 66
48 Dou W W, Jia R, Jin P, et al. Investigation of the mechanism and characteristics of copper corrosion by sulfate reducing bacteria [J]. Corros. Sci., 2018, 144: 237
49 Jia R, Tan J L, Jin P, et al. Effects of biogenic H2S on the microbiologically influenced corrosion of C1018 carbon steel by sulfate reducing Desulfovibrio vulgaris biofilm [J]. Corros. Sci., 2018, 130: 1
50 Smith M, Bardiau M, Brennan R, et al. Accelerated low water corrosion: The microbial sulfur cycle in microcosm [J]. NPJ Mater. Degrad., 2019, 3: 37
51 Liu H F, Dong Z H, Xu L M. The influence of Fe2+ on the microbiological corrosion of carbon steel [J]. Corros. Prot., 1998, 19: 210
51 刘宏芳, 董泽华, 许立铭. Fe2+对碳钢的微生物腐蚀作用的影响 [J]. 腐蚀与防护, 1998, 19: 210
52 King J K, Harmon S M, Fu T T, et al. Mercury removal, methylmercury formation, and sulfate-reducing bacteria profiles in wetland mesocosms [J]. Chemosphere, 2002, 46: 859
53 De Romero M, Duque Z, Rodríguez L, et al. A study of microbiologically induced corrosion by sulfate-reducing bacteria on carbon steel using hydrogen permeation [J]. Corrosion, 2005, 61: 68
54 Dumlu F A, Aydin T, Odabasoglu F, et al. Anti-inflammatory and antioxidant properties of jervine, a sterodial alkaloid from rhizomes of Veratrum album [J]. Phytomedicine, 2019, 55: 191
55 Venzlaff H, Enning D, Srinivasan J, et al. Accelerated cathodic reaction in microbial corrosion of iron due to direct electron uptake by sulfate-reducing bacteria [J]. Corros. Sci., 2013, 66: 88
56 Iverson W P. Research on the mechanisms of anaerobic corrosion [J]. Int. Biodeterior. Biodegrad., 2001, 47: 63
57 Starkey R L. The general physiology of the sulfate-reducing bacteria in relation to corrosion [J]. Prod. Month., 1958, 22: 12
58 King R A, Miller J D A. Corrosion by the sulphate-reducing bacteria [J]. Nature, 1971, 233: 491
59 Ye Q. Microbiologically influenced corrosion in oilfield flooding water [D]. Wuhan: Huazhong University of Science & Technology, 2013
59 叶琴. 污水介质中的微生物腐蚀 [D]. 武汉: 华中科技大学, 2013
60 Guo J N, Huang Y M, Lin L J, et al. The study of the oxygen concentration cell corrosion of low alloy steel in sea water [J]. J. Chin. Soc. Corros. Prot., 1982, 2: 59
60 郭津年, 黄亚敏, 林连进等. 低合金钢在海水中氧浓差腐蚀的研究 [J]. 中国腐蚀与防护学报, 1982, 2: 59
61 Ge R G. Failure analysis of marine casing [J]. Total Corros. Control, 2011, 25(7): 45
61 戈仁刚. 海洋油井套管断裂原因分析 [J]. 全面腐蚀控制, 2011, 25(7): 45
62 Moon K M, Lee M H, Kim K J, et al. An electrochemical study on the microbiological influenced corrosion of steels sulfate-reducing bacteria [J]. Sci. & Tech., 2002, 11(1): 67
63 Moon K M, Cho H R, Lee M H, et al. Electrochemical analysis of the microbiologically influenced corrosion of steels by sulfate-reducing bacteria [J]. Met. Mater. Int., 2007, 13: 211
64 Al-Saadi S, Singh Raman R K. A long aliphatic chain functional silane for corrosion and microbial corrosion resistance of steel [J]. Prog. Organ. Coat., 2019, 127: 27
65 Shamsuddin R A, Bakar M H A, Daud W R W, et al. Can electrochemically active biofilm protect stainless steel used as electrodes in bioelectrochemical systems in a similar way as galvanic corrosion protection? [J]. Int. J. Hydrogen Energy, 2019, 44: 30512
66 Rasheed P A, Jabbar K A, Rasool K, et al. Controlling the biocorrosion of sulfate-reducing bacteria (SRB) on carbon steel using ZnO/chitosan nanocomposite as an eco-friendly biocide [J]. Corros. Sci., 2019, 148: 397
67 Dinh H T, Kuever J, Mu?mann M, et al. Iron corrosion by novel anaerobic microorganisms [J]. Nature, 2004, 427: 829
68 Tang H Y, Holmes D E, Ueki T, et al. Iron corrosion via direct metal-microbe electron transfer [J]. Mbio, 2019, 10(3): e00303-19
69 Gu T Y, Ru J, Unsal T, et al. Toward a better understanding of microbiologically influenced corrosion caused by sulfate reducing bacteria [J]. J. Mater. Sci. Technol., 2019, 35: 631
70 Jiang Y, Zeng R J. Bidirectional extracellular electron transfers of electrode-biofilm: Mechanism and application [J]. Bioresour. Technol., 2019, 271: 439
71 Enning D, Venzlaff H, Garrelfs J, et al. Marine sulfate-reducing bacteria cause serious corrosion of iron under electroconductive biogenic mineral crust [J]. Environ. Microbiol., 2012, 14: 1772
72 Li Y C, Xu D K, Chen C F, et al. Anaerobic microbiologically influenced corrosion mechanisms interpreted using bioenergetics and bioelectrochemistry: a review [J]. J. Mater. Sci. Technol., 2018, 34: 1713
73 Sherar B W A, Power I M, Keech P G, et al. Characterizing the effect of carbon steel exposure in sulfide containing solutions to microbially induced corrosion [J]. Corros. Sci., 2011, 53: 955
74 Reguera G, McCarthy K D, Mehta T, et al. Extracellular electron transfer via microbial nanowires [J]. Nature, 2005, 435: 1098
75 Shi L, Dong H L, Reguera G, et al. Extracellular electron transfer mechanisms between microorganisms and minerals [J]. Nat. Rev. Microbiol., 2016, 14: 651
76 Jia R, Yang D Q, Xu D K, et al. Electron transfer mediators accelerated the microbiologically influence corrosion against carbon steel by nitrate reducing Pseudomonas aeruginosa biofilm [J]. Bioelectrochemistry, 2017, 118: 38
77 Zhang P Y, Xu D K, Li Y C, et al. Electron mediators accelerate the microbiologically influenced corrosion of 304 stainless steel by the Desulfovibrio vulgaris biofilm [J]. Bioelectrochemistry, 2015, 101: 14
78 Huang Y, Zhou E Z, Jiang C Y, et al. Endogenous phenazine-1-carboxamide encoding gene PhzH regulated the extracellular electron transfer in biocorrosion of stainless steel by marine Pseudomonas aeruginosa [J]. Electrochem. Commun., 2018, 94: 9
79 Guan F, Zhai X F, Duan J Z, et al. Influence of sulfate-reducing bacteria on the corrosion behavior of high strength steel EQ70 under cathodic polarization [J]. PLoS ONE, 2016, 11: e0162315
80 Guan F. Research on the corrosion mechanism of sulfate-reducing bacteria under cathodic protection [D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2017
80 管方. 阴极保护下硫酸盐还原菌腐蚀机理研究 [D]. 青岛: 中国科学院大学 (中国科学院海洋研究所), 2017
81 Gu T Y, Zhao K, Nesic S. A practical mechanistic model for MIC based on a biocatalytic cathodic sulfate reduction (BCSR) theory [A]. Corrosion 2009 [C]. Atlanta, 2009: 09390
82 Xu D K, Gu T Y. Carbon source starvation triggered more aggressive corrosion against carbon steel by the Desulfovibrio vulgaris biofilm [J]. Int. Biodeterior. Biodegrad., 2014, 91: 74
83 Li Y F, Ning C Y. Latest research progress of marine microbiological corrosion and bio-fouling, and new approaches of marine anti-corrosion and anti-fouling [J]. Bioact. Mater., 2019, 4: 189
84 Xie F, Li X, Wang D, et al. Synergistic effect of sulphate-reducing bacteria and external tensile stress on the corrosion behaviour of X80 pipeline steel in neutral soil environment [J]. Eng. Fail. Anal., 2018, 91: 382
85 Xie F, Wang X F, Wang D, et al. Effect of strain rate and sulfate reducing bacteria on stress corrosion cracking behaviour of X70 pipeline steel in simulated sea mud solution [J]. Eng. Fail. Anal., 2019, 100: 245
86 Jia R, Wang D, Jin P, et al. Effects of ferrous ion concentration on microbiologically influenced corrosion of carbon steel by sulfate reducing bacterium Desulfovibrio vulgaris [J]. Corros. Sci., 2019, 153: 127
87 Zhao Y, Zhou E Z, Liu Y Z, et al. Comparison of different electrochemical techniques for continuous monitoring of the microbiologically influenced corrosion of 2205 duplex stainless steel by marine Pseudomonas aeruginosa biofilm [J]. Corros. Sci., 2017, 126: 142
88 Zhou E Z, Li H B, Yang C T, et al. Accelerated corrosion of 2304 duplex stainless steel by marine Pseudomonas aeruginosa biofilm [J]. Int. Biodeterior. Biodegrad., 2018, 127: 1
89 Yuan S J, Pehkonen S O. AFM study of microbial colonization and its deleterious effect on 304 stainless steel by Pseudomonas NCIMB 2021 and Desulfovibrio desulfuricans in simulated seawater [J]. Corros. Sci., 2009, 51: 1372
90 Xu P, Ren H Y, Wang C Z, et al. Research progress on mixture microbial corrosion and analytical method on metal surface [J]. Surf. Technol., 2019, 48: 216
90 许萍, 任恒阳, 汪长征等. 金属表面混合微生物腐蚀及分析方法研究进展 [J]. 表面技术, 2019, 48: 216
91 Skovhus T L, Eckert R B, Rodrigues E. Management and control of microbiologically influenced corrosion (MIC) in the oil and gas industry-Overview and a North Sea case study [J]. J. Biotechnol., 2017, 256: 31
92 El Menjra A I, Seyeux A, Mercier D, et al. ToF-SIMS analysis of abiotic and biotic iron sulfide layers formed in aqueous conditions on iron surfaces [J]. Appl. Surf. Sci., 2019, 484: 876
93 Li Y C, Feng S Q, Liu H M, et al. Bacterial distribution in SRB biofilm affects MIC pitting of carbon steel studied using FIB-SEM [J]. Corros. Sci., 2020, 167: 108512
94 Javaherdashti R. Impact of sulphate-reducing bacteria on the performance of engineering materials [J]. Appl. Microbiol. Biotechnol., 2011, 91: 1507
95 Videla H A, Herrera L K. Microbiologically influenced corrosion: looking to the future [J]. Int. Microbiol., 2005, 8: 169
96 Davidova I A, Duncan K E, Perez-Ibarra B M, et al. Involvement of thermophilic archaea in the biocorrosion of oil pipelines [J]. Environ. Microbiol., 2012, 14: 1762
97 Suflita J M, Aktas D F, Oldham A L, et al. Molecular tools to track bacteria responsible for fuel deterioration and microbiologically influenced corrosion [J]. Biofouling, 2012, 28: 1003
98 Beech I B, Sunner J A, Hiraoka K. Microbe-surface interactions in biofouling and biocorrosion processes [J]. Int. Microbiol., 2005, 8: 157
99 Palacios P A, Snoeyenbos-West O, L?scher C R, et al. Baltic sea methanogens compete with acetogens for electrons from metallic iron [J]. ISME J., 2019, 13: 3011
100 Zhai X F, Guan F, Wang N, et al. Preparation of DCOIT composited Zn-Ni alloy antibacterial coatings and sulfate-reducing bacterial corrosion resistance [J]. Surf. Technol., 2019, 48(7): 247
100 翟晓凡, 管方, 王楠等. DCOIT复合Zn-Ni合金抗菌镀层的制备及其耐SRB腐蚀性能研究 [J]. 表面技术, 2019, 48(7): 247
101 Liu H W, Cheng Y F. Mechanism of microbiologically influenced corrosion of X52 pipeline steel in a wet soil containing sulfate-reduced bacteria [J]. Electrochim. Acta, 2017, 253: 368
102 Bradley A S, Leavitt W D, Johnston D T. Revisiting the dissimilatory sulfate reduction pathway [J]. Geobiology, 2011, 9: 446
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414





