海洋具有丰富的自然资源和经济价值,并具有巨大的国防战略意义,国家正不断推进 海洋资源的开发利用。X65 钢由于具有耐腐蚀性好、强度高、抗断裂韧性优良、价格实惠等 优点,被广泛应用在石油、天然气运输中[1]。但海洋环境复杂恶劣,海洋构筑物面临着严重 的腐蚀问题,微生物腐蚀是其中最普遍、最复杂的类型。据统计,微生物腐蚀约占金属腐蚀 的 20%[2],且极易造成金属材料穿孔,因此带来巨大的安全风险。
在众多腐蚀微生物中,铁氧化菌(IOB)是腐蚀最严重的微生物之一。在海洋环境中,它 们会迅速附着在材料表面[3,4],短时间内会抑制其他微生物的附着。同时,IOB 形成的生物 膜会促进厌氧环境的形成,从而促进其他厌氧菌的生长[5-7]。它们可以从亚铁离子氧化成铁 离子的过程中获得能量来维持生命活动[8],氧化速率远高于非生物氧化[9,10]。这会导致氢氧 化铁的沉积,不均匀的覆盖在材料表面,形成氧浓差电池,促进点蚀[11-14]。目前,研究表明, IOB 的存在可以加速金属溶解和局部腐蚀[15-18]。
阴极保护是海洋构筑物广泛采用的腐蚀控制措施,它不仅可以抑制腐蚀的发生,对微生 物本身也具有一定的抑制作用。但对于微生物存在下的阴极保护电位选择仍存在争议[19]。在实际工况条件下,由于外界环境的不断变化,阴极保护电位也往往会发生偏移,难以保持 稳定。在之前的研究中我们发现[23],较负的极化电位具有更好的保护作用。那么,在较正 的电位下发生 IOB 腐蚀后,较负的电位能否起到修复作用;在较负的电位下保护良好的状 况下,在较正的电位下还能否保持一定的抗腐蚀能力?这些问题对研究阴极保护的抑菌机 理、制定适合的阴极保护规范具有重要的理论价值和应用价值。
1. 实验方法
本文所用试样为 X65 管线钢,化学成分 (质量分数,%)为:C 0.03, Si 0.17, Mn 1.51, P 0.02, Ni 0.17, Cu 0.04, Mo 0.16, Nb 0.06, Al 0.02, Ti 0.01, Fe 余量。将 10 mm×10 mm×3 mm 尺寸的 试样用铜导线焊接,再用环氧树脂密封,只保留 10 mm×10 mm 工作面。依次用 400 #、800#、1000 #、2000 #的 SiC 砂纸对试样的每个工作面进行打磨,再用无水乙醇清洗,干燥。使 用前在紫外灯下照射试样 30 min 灭菌。
所用培 养基 用青岛 小麦 岛附近 天然 陈化海 水配 置,成 分( g/L )为:K2HPO4 0.5, MgSO4·7H2O 0.5, NaNO3 0.5, (NH4)2SO4 0.5, CaCl2 0.2,柠檬酸铁铵 10。全培养基用于 IOB 培 养与计数,细菌计数采用最大可能数法(MPN)。
为减小培养基成分对腐蚀的影响,用陈化海水将培养基稀释 20 倍,得到实验用腐蚀介质。培养基与腐蚀介质均用 2 mol/L 的 NaOH 调节 pH 至 8.1±0.1,并用高压蒸汽灭菌锅高 温 121 ℃下灭菌 20 min。实验前,向灭菌后的培养基中接种铁氧化菌,在恒温培养箱(30 ℃) 中培养 5 d,按 1:100 体积比接种到腐蚀体系中进行实验,实验温度用恒温水浴锅控制在 25 ±1 ℃。
在海洋环境中,碳钢的阴极保护电位一般在-800~-1050 mV vs. Ag/AgCl/海水电极范围内[24](即-806~-1056 mVvs. SCE),当有微生物存在时,保护电位往往需要适当负移。但保护电位负于-1050 mV 时会大大增加析氢的风险,所以本文选择较正的-850 mV vs. SCE 与阴极保护极限电 位-1050 mV 组合。最终选用 X65 钢在有菌体系的开路电位(由于腐蚀产物层的形成,开路电 位正移,稳定后约-710 mV vs. SCE 下同)、-850 mV 转-1050 mV、-1050 mV 转-850 mV,在第 3 d,IOB 生长阶段进入稳定期[15]时进行转换。
电化学测试采用经典的三电极体系,工作电极为 X65 钢,辅助电极为钛基底贵金属氧 化物电极,参比电极为饱和甘汞电极(SCE)。采用 Gamry Reference 600 工作站进行相关电化 学测试。在测试前 1 h 断开极化电位,等待体系开路电位(OCP)稳定后进行测试。电化学阻 抗谱(EIS)测试参数:在开路电位下施加电压扰动信号幅值 10 mV,扫描频率范围为 105 -10-2Hz。
浸泡 7 d 后,从腐蚀体系中取出试样,用 5 mL 注射器吸取灭菌冷却后的磷酸盐 pH 缓 冲溶液,轻轻冲洗表面 3 次以除去剩余的培养基和浮游细菌,放入 5 %戊二醛固定液中固定2 h,依次用 10 %、30 %、50 %、70 %、90 %、95 %无水乙醇脱水 10 min,再放入 100 %无 水乙醇中脱水 20 min,用于扫描电子显微镜(SEM, ZEISS-Gemini 300)观察。
用蒸馏水清洗干净待测试样表面,用无水乙醇浸泡 3 分钟以出去表面残余的水,干燥后 用于表面拉曼测试(Thermo Fisher Scientific- DXR Microscope)。
用蒸馏水冲洗掉表面残留溶液,然后用除锈液(20 g 六次甲基四胺溶于 1 L 1:1(V/V)的盐 酸中)浸泡 3 min,取出后再用蒸馏水冲洗干净,放入无水乙醇中浸泡 5 min 后干燥,用于激 光共聚焦显微镜(Keyence- VK-X200)观察。
2. 结果与讨论
2.1 IOB 生长情况
IOB 在 pH 为 8.1 的海水中生长曲线如图 1 所示。看出,1-2 d 时 IOB 迅速生长,为对 数生长期,之后进入稳定期,数量较为稳定。6 d 后由于营养物质消耗,数量有所减少。
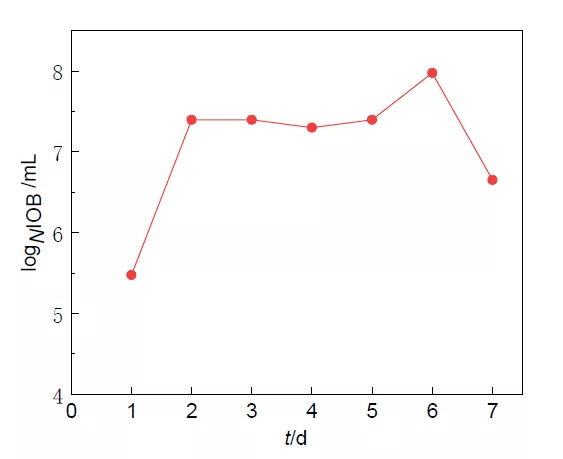
图 1 铁氧化菌的生长曲线
图 2 为 3 d 时不同电位条件下溶液中 IOB 数量。可以看到,随着初始电位的负移,IOB数量有所减少。-850 转-1050 mV 极化下 IOB 数量相差不大,说明-850 mV 极化对 IOB 的抑 制效果较弱,IOB 仍能在电极表面附着并形成生物膜。而-1050 mV 转-850 mV 极化明显抑制了 IOB 的数量。
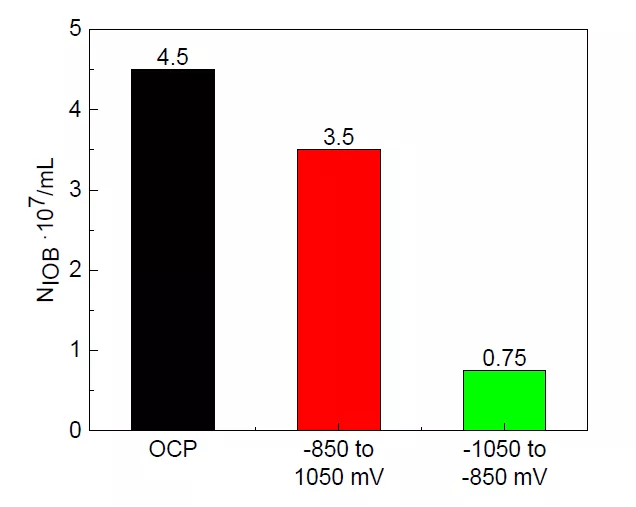
图 2 不同阴极电位下 3 d 时溶液中 IOB 数量
2.2 表面形貌与成分分析
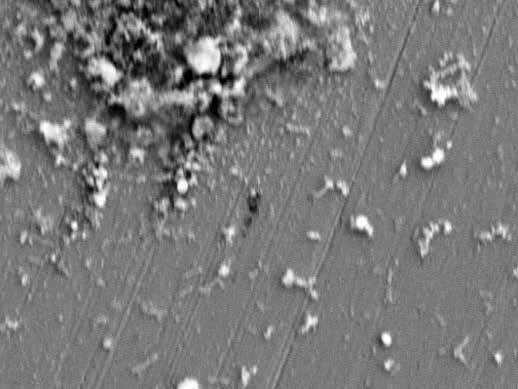
图 3 为开路电位和-850 mV 转-1050 mV、-1050 mV 转-850 mV 两种组合极化电位下, X65 钢浸泡 7 d 时的表面形貌图。可以看到,3 种条件下腐蚀产物都未完全覆盖试样表面。在开路电位条件下,试样表面十分杂乱,附着有细菌和大量疏松的腐蚀产物。-850 mV 转-1050 mV 条件下,腐蚀产物虽然有所减少,但仍能观察到较明显的点蚀痕迹。-1050 mV 转-850 mV 条件下,试样表面附着的腐蚀产物较少且致密,没有发现明显的杆状细菌。这可能是由于-850 mV 极化对 IOB 的抑制较小,前 3d 时 IOB 在试样表面附着并形成生物膜。后 4d 施加的-1050 mV 极化不能完全去除已形成的生物膜,同时,大量的腐蚀产物造成电极表面电位分布不均, 更减弱了阴极极化的抑菌效果。先施加-1050 mV 极化时,不仅抑制了 IOB 的附着,还大量杀死了处于对数生长期的细菌,抑制了体系中 IOB 数量的增长,大大减轻了 IOB 造成的腐蚀;再施加-850 mV 极化,由于体系中 IOB 数量较少,对腐蚀的促进不明显。
图 3 不同组合电位下浸泡 7 d 后 X65 钢表面形貌图
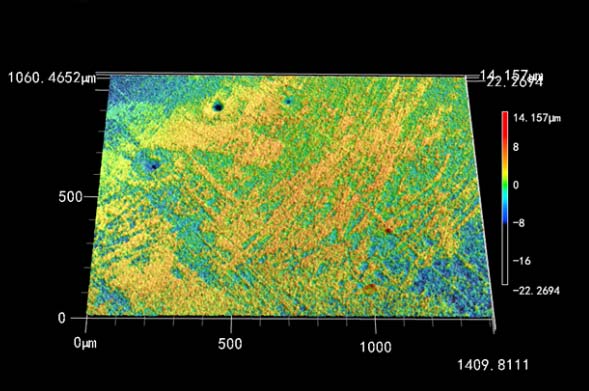
去除腐蚀产物后,利用激光共聚焦显微镜观察试样基底,如图 4 所示。可以看到,3 种 条件下,试样表面都出现了明显的蚀坑。阴极极化的施加使蚀坑深度明显减少。-1050 mV 转-850 mV 条件下,试样基底表面较为光滑,还能看到打磨的痕迹,坑深也显著低于-850 mV 转-1050 mV。说明两组组合电位极化对 IOB 腐蚀都有一定抑制作用,而-1050 mV 转-850 mV 极化保护效果优于-850 mV 转-1050 mV,与 SEM 观察结果相符。
图 4 不同阴极电位下极化 7 d 后去除试样表面腐蚀产物后基底形貌
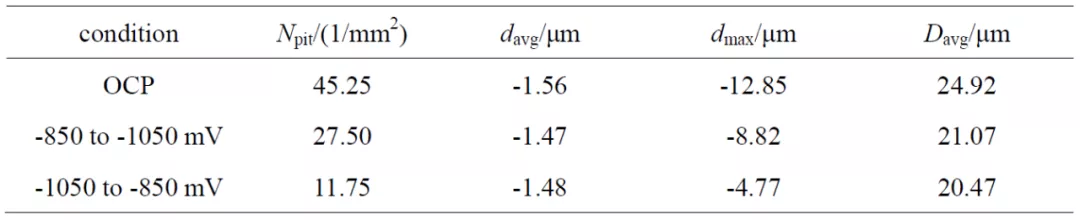
利用激光共聚焦显微镜对图 4 中试样表面进行测量,随机选取 4 个区域测量后计算平均 值,数据列于表 1 中。Npit 为每平方毫米蚀坑个数,davg 为蚀坑平均深度,dmax 为蚀坑最大深 度,Davg 为蚀坑等效平均直径。可以看到,两种极化条件下,试样表面蚀坑数量、平均深度、 最大深度、等效直径均小于开路电位条件下的。而在两种组合极化条件下,虽然平均蚀坑深 度相近,但-850 mV 转-1050 mV 极化组合电位条件下的蚀坑数、最大坑深、平均蚀坑直径 都要高于-1050 转 -850 mV 极化组合电位条件下的。
表 1 X65 钢在不同阴极电位下极化 7 d 后去除腐蚀产物的激光共聚焦显微镜测量数据
对 X65 钢在不同条件下浸泡 7 d 后的腐蚀产物进行拉曼测试,结果如图 5。从分析结果可以看出,3 种条件下腐蚀产物种类基本相同,主要由 FeOOH、Fe2O3、Fe3O4 组成,只是 含量有差别。Refait 等[26]研究了阴极保护下碳钢在海水中的腐蚀产物,也发现极化条件下的 腐蚀产物与开路电位条件下的腐蚀产物种类基本相同。相比开路电位,极化条件下的电极表面 pH 上升导致 CaCO3 和 Mg(OH)2 形成较快,在约 1100 和 420 cm-1 出现一个较弱的峰。
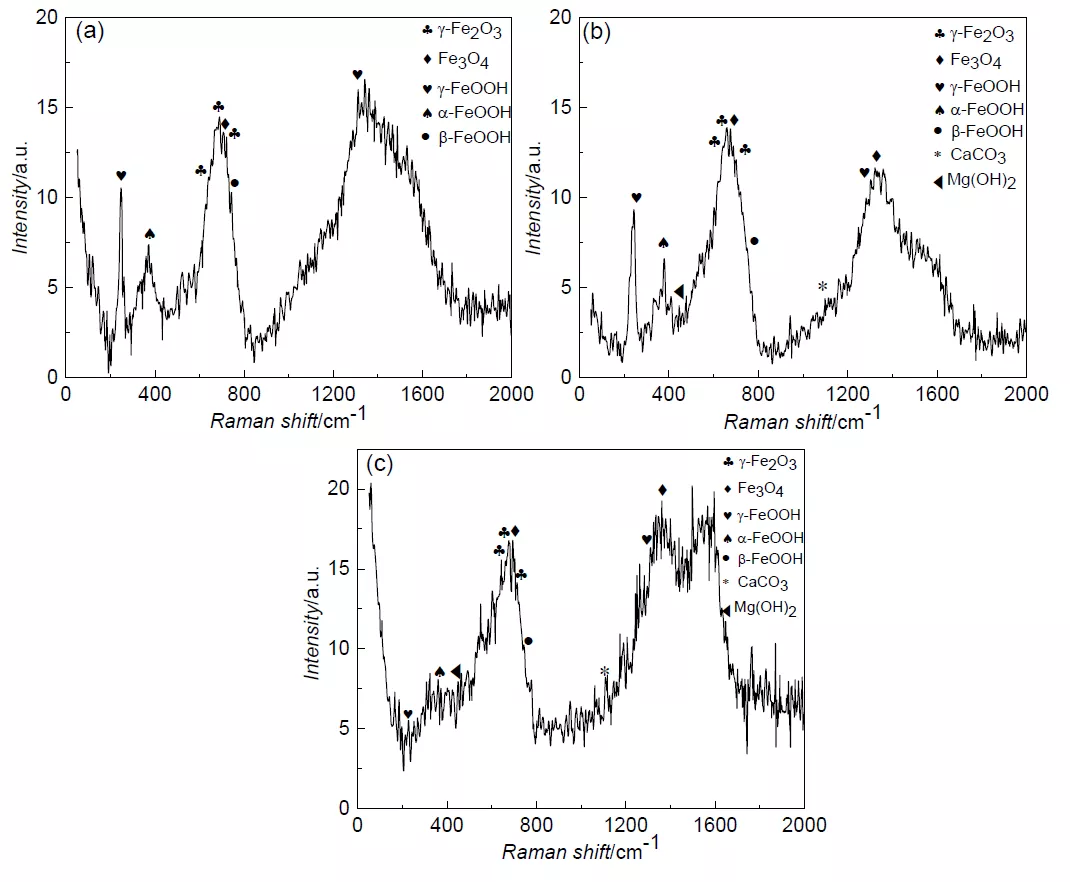
图 5 不同阴极电位下极化 7 d 后 X65 钢表面拉曼谱图
2.3 电化学特征
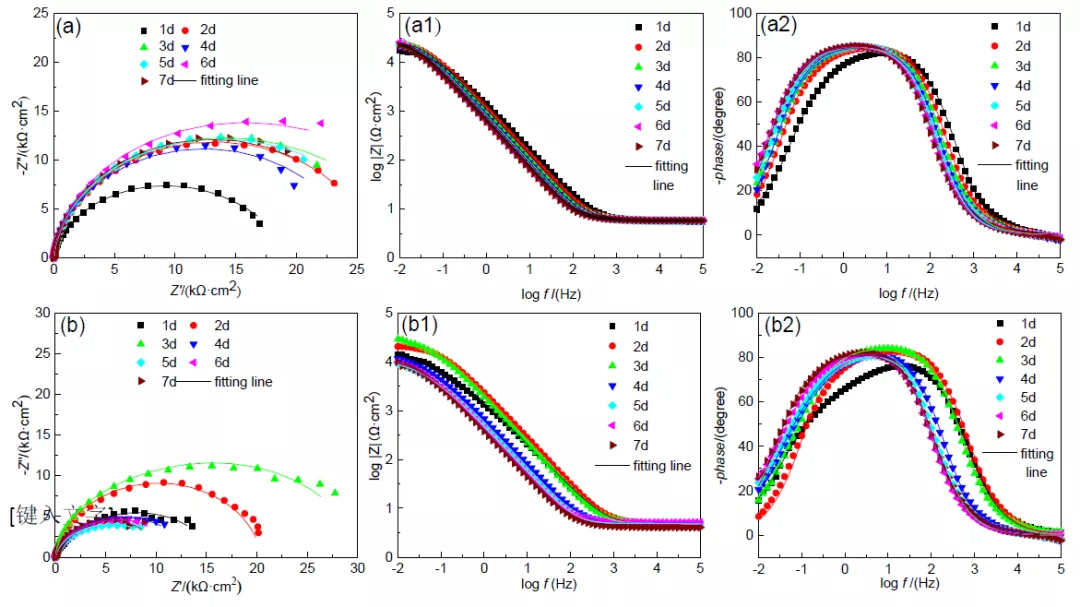
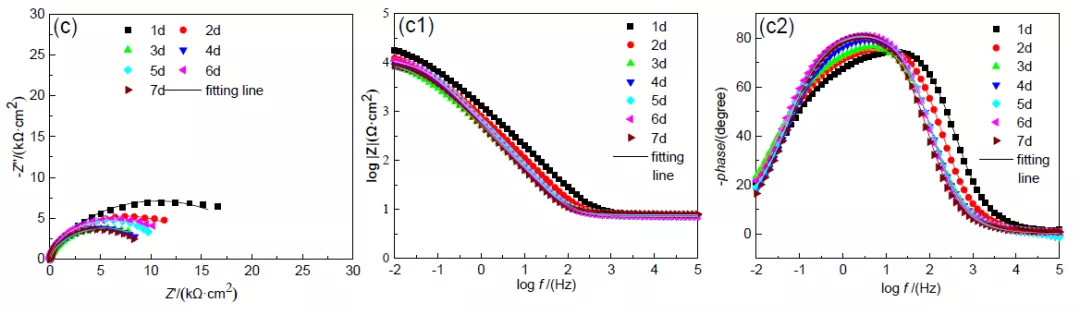
图 6 不同阴极电位下极化不同后 X65 钢的电化学阻抗图
在测试前 1 h 断开极化,待体系开路电位稳定后对试样进行交流阻抗测试,连续测试 7 d, 测试结果绘于图 5 中。从图 6a 中可以看出,1-2 d 时容抗弧半径逐渐增大,3 d 之后保持相 对稳定并不断波动。从图 6b 可以看到,-850 转-1050 mV 组合电位极化下,1-3 d 时 X65 钢 容抗弧随浸泡时间延长而增大,第 4 d 时突然下降后保持稳定;而-1050 转-850 mV 组合电 位极化下,容抗弧在 1-3 d 逐渐减小,4-6 d 逐渐上升,第 7 d 时又再次下降。
由于 IOB 的存在,试样表面有生物膜、腐蚀产物膜形成,本文选用图 7 的等效电路对 阻抗数据进行拟合,Rf 与 Cf 随时间变化绘与图 8 中。其中,Rs 为溶液电阻,Qdl 为双电层电容,Rct 为电荷转移电阻,Qf 为常相位角元件,Cf 为膜电容,n 为弥散系 数,Rf 为膜电阻。
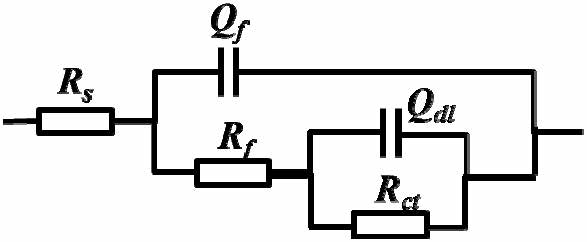
图 7 电化学阻抗谱拟合等效电路图
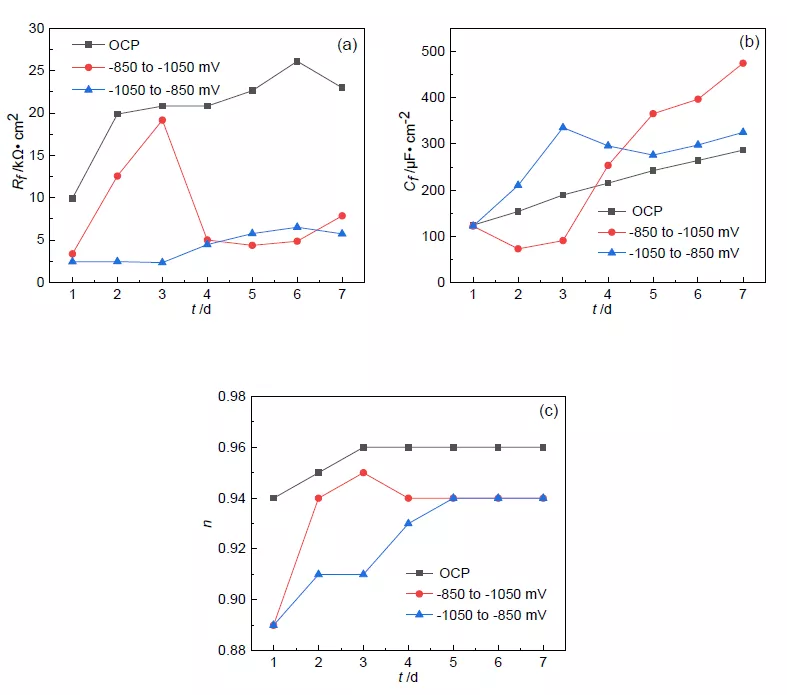
图 8 电化学阻抗谱拟合参数随时间变化曲线
如图 8a 所示,OCP 条件下,IOB 可以在电极表面附着形成具有保护作用的生物膜[15], Rf 不断增大。-850 转-1050 mV 组合电位极化下,因为-850 mV 极化抑制效果较弱,IOB 仍 能在电极表面附着,Rf 迅速上升;3 d 后,-1050 mV 极化的施加破坏了电极表面部分已形成 的生物膜,Rf 显著下降;之后由于极化导致的 pH 上升,逐渐形成钙镁沉积层,Rf 缓慢上升。而在-1050 mV 转-850 组合电位极化下,由于 IOB 附着被抑制,Rf 较小且变化不大;4 d 时 由于极化电位变正,IOB 迅速附着生长,Rf 逐渐增大;7 d 时由于生物膜局部脱落,Rf 减小。
在图 8b 和 c 中,开路电位下,由于 IOB 在电极表面附着,生物膜面积不断增大,n 和 Cf 不断增大。在-850 转-1050 mV 极化下,3 d 后由于电位变负,电极表面生物膜被部分破坏, 膜层变薄且不完整,Cf 迅速增大,n 减小。而在-1050 转-850 mV 极化下,3-5 d 时由于电位 变正,IOB 受到的抑制减弱,生物膜逐渐变厚,Cf 逐渐减小。但电化学测试结果不能表征试 样的点蚀。
结合试样表面形貌和成分分析结果,在开路电位下,试样表面有细菌附着,腐蚀严重且 有明显的坑蚀,产物成分主要为 FeOOH、Fe2O3、Fe3O4,为粘附腐蚀产物的生物膜,生物 膜的存在使 Rf 较大,但保护作用较弱。在极化条件下,特别是-1050 转-850 mV 极化下,试 样表面细菌数量明显减少,产物膜中 α-FeOOH 明显含量下降,并有少量 CaCO3 和 Mg(OH)2生成,说明生物膜的生长受到抑制,钙镁沉积层逐渐形成,由于钙镁沉积层未完全覆盖表面 导致 Rf 小于开路电位条件下,但保护效果较好,抑制了点蚀的发生。
不同阴极电位下电极表面状态如图 9 所示。在开路电位下,IOB 迅速在电极表面附着成膜,诱发点蚀[28]。在-850 mV 转-1050 mV 极化下,如图 9b,-850 mV 极化对 IOB 抑制效果 较弱,生成的少量钙质沉积层也不能起到良好的保护作用,电极表面有点蚀发生。当电位负 移后,-1050 mV 部分破坏了已形成的生物膜,但并未完全去除,仍附着的 IOB 继续促进点 蚀的发生[29],[30]。而在图 9c 中,先施加的-1050 mV 极化较好的抑制了 IOB 的生长与附着, 电极表面只有少量 IOB 附着,生成的钙镁沉积层有具有一定的保护作用。当电位正移后, 溶液中的 IOB 数量较少,同时,已形成的钙镁沉积层阻碍了 IOB 与试样直接接触,所以试样腐蚀较轻。
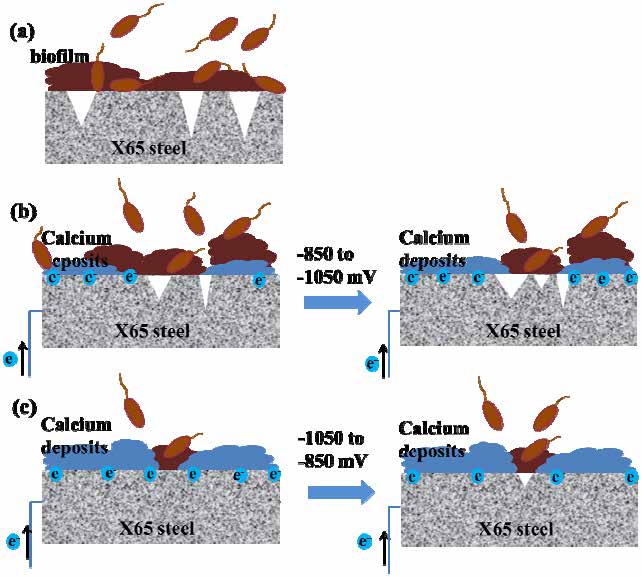
图 9 不同阴极电位下 X65 钢表面状态图
3. 结论
(1) 两种组合电位阴极极化都对 IOB 腐蚀有抑制作用,X65 钢表面仍有点蚀发生。
(2) 极化与开路电位条件下 X65 钢试样表面腐蚀产物种类基本相同,但极化条件下试 样表面有 CaCO3 和 Mg(OH)2 生成。
(3) -1050 mV 转-850 mV 极化组合电位的保护效果要优于-850 mV 转-1050 mV 极化, 这可能是由于前期施加-1050 mV 极化可以有效抑制 IOB 的附着与生长,从而抑制了IOB 腐蚀的发生。但后期施加的-1050 mV 极化不能完全去除已形成的生物膜,不均匀 的生物膜导致电极界面电位分布不均,IOB 仍能在电极表面电位较正处生长,从而促 进腐蚀。
参考文献
[1] Xu Z. Study on Constitutive Relation and Failure Criteria of X65 Pipeline Steel[J] . Petro. Eng. Constr., 2014, 40: 23 (徐震。X65 管线钢的本构关系及失效判据研究[J] .石油工程建设, 2014, 40: 23)
[2] Shi X B, Yang C G, Yan W, et al. Microbiologically influenced corrosion of pipeline steels[J] . J. Chin. Soc. Corros. Prot., 2019, 39: 9 (史显波,杨春光,严伟等。管线钢的微生物腐蚀[J] .中国腐蚀与防护学报,2019, 39: 9)
[3] McBeth J M, Little B J, Ray R I, et al. Neutrophilic iron-oxidizing “ Zetaproteobacteria ” and mild steel corrosion in nearshore marine environments[J] . Appl. Environ. Microbiol., 2011, 77: 1405
[4] McBeth J M, Emerson D. In situ microbial community succession on mild steel in estuarine and marine environments: exploring the role of iron-oxidizing bacteria[J] . Front Microbiol., 2016, 7: 767
[5] Liu H W, Fu C Y, Gu T Y, et al. Corrosion behavior of carbon steel in the presence of sulfate reducing bacteria and iron oxidizing bacteria cultured in oilfield produced water[J] . Corro. Sci. 2015, 100: 484
[6] Zhang H Y, Tian Y M, Wan J M, et al. Study of biofilm influenced corrosion on cast iron pipes in reclaimed water[J] . Appl. Surf. Sci., 2015, 357: 236
[7] Lv M Y, Du M, Li X, Yue Y Y, et al. Mechanism of microbiologically influenced corrosion of X65 steel in seawater containing sulfate-reducing bacteria and iron-oxidizing bacteria[J] . J. Mater. Res. Technol., 2019, 8: 4066
[8] Emerson D, Moyer C. Isolation and characterization of novel iron-oxidizing bacteria that grow at circumneutral pH[J] . Appl. Environ. Microbiol., 1997, 63: 4784
[9] Sung W, Morgan J J. Kinetics and product of ferrous iron oxygenation in aqueous systems[J] . Environ. Sci. Technol., 1980, 14: 561
[10] Sobolev D, Roden E E. Characterization of a neutrophilic, chemolithoautotrophic Fe(II)-oxidizing alpha-proteobacterium from freshwater wetland sediments[J] . Geomicrobiol. J., 2004, 21: 1
[11] Starosvetsky D, Armonb R, Yahaloma J, et al, Pitting corrosion of carbon steel caused by iron bacteria[J] . Int. Biodeterior. Biodegrad., 2011, 47: 79
[12] Starosvetsky J, Starosvetsky D, Pokroy B, et al. Electrochemical behaviour of stainless steels in media containing iron-oxidizing bacteria (IOB) by corrosion process modeling[J] . Corro. Sci., 2008, 50: 540
[13] Moradi M, Duan J, Ashassi-Sorkhabi H, et al. De-alloying of 316 stainless steel in the presence of a mixture of metal-oxidizing bacteria[J] . Corro. Sci., 2011, 53: 4282
[14] Miot J, Benzerara K, Morin G, et al. Iron biomineralization by anaerobic neutrophilic iron-oxidizing bacteria[J] .Geochim. Cosmochim. Acta., 2009, 73: 696
[15] Yue Y Y, Lv M Y, Du M. The corrosion behavior and mechanism of X65 steel induced by iron-oxidizing bacteria in the seawater environment[J] . Mater. Corros., 2019,10: 1852
[16] Wang H, Ju L K, Castaneda H, et al. Corrosion of carbon steel C1010 in the presence of iron oxidizing bacteria Acidithiobacillus ferrooxidans[J] . Corro. Sci., 2014, 89: 250
[17] Wang K T, Chen F, Li H, et al. Corrosion behavior of L245 pipeline steel in Shale gas fracturing produced water containing iron bacteria[J] . J. Chin. Soc. Corros. Prot., 2021, 41: 248 (王坤泰, 陈馥, 李环,等。铁细菌对 L245 钢腐蚀行为的影响研究[J] , 中国腐蚀与防护学报, 2021, 41: 248 )
[18] Lv Y L, Liu H W, Xiong F P, et al. Corrosion behavior of X80 pipeline steel in oil-field produced water containing iron oxidizing bacteria[J] . Corro. Sci. Prot. Technol., 2017, 29: 343.(吕亚林, 刘宏伟, 熊福平,等。铁氧化菌对 X80 管线钢腐蚀行为的影响[J] , 腐蚀科学与防护技术, 2017, 29: 343)
[19] Esquivel R G, Olivares G Z, Gayosso M G H, et al. Cathodic protection of XL 52 steel under the influence of sulfate reducing bacteria[J] . Mater. Corros., 2011, 62: 61
[20] Guan F, Zhai X F, Duan J Z, et al. Influence of sulfate-reducing bacteria on the corrosion behavior of high strength steel EQ70 under cathodic polarization[J] . PLoS One, 2016, 11: e0162315
[21] Sun C, Xu J, Wang F H, et al. Effects of SRB on cathodic protection of Q235 steel in soils[J]. Mater. Corros., 2010, 61: 762 [22] Samanbar Permeh, Kingsley Lau, Berrin Tansel, et al.Surface conditions for microcosm development and proliferation of SRB on steel with cathodic corrosion protection[J] Construction and Building Materials, 2020(243):118209
[23] Lv M Y, Yue Y Y, Li Z X, et al. Effect of Cathodic Polarization on Corrosion Behavior of X65 Steel in Seawater Containing Iron-oxidizing Bacteria[J] . Int. J. Electrochem. Sci., 2021, 16: 1 [24] DNV RP B401-2010: Cathodic protection design
[25] Liu H W, Liu W F. Research Progress of Corrosion of Steels Induced by Iron Oxidizing Bacteria[J] . J. Chin. Soc. Corros. Prot., 2017, 37: 195 (刘宏伟, 刘宏芳。 铁氧化菌引起的钢铁材料腐蚀研究进展[J] . 中国腐蚀与防护学报, 2017, 37: 195)
[26] Refait P, Jeannin M, Sabot R, et al. Electrochemical formation and transformation of corrosion products on carbon steel under cathodic protection in seawater[J] Corro. Sci., 2013, 71: 32
[27] Gunasekaran G, Chongdar S. Influence of bacteria on film formation inhibiting corrosion[J] . Corro. Sci., 2004, 46: 1953
[28] Niu Y, Lin Z L, Lin G J, et al. Research on corrosion behavior of Q235 steel in marine iron-oxidizing bacteria[J] . Marine Environ. Sci., 2014, 33: 739 (牛艳, 林振龙, 林国基, 等。Q235 钢在海洋铁细菌作用下的腐蚀行为研究[J] . 海洋环境科学,2014, 33: 739)
[29] Li X B, Wang J. Effect of cathodic polarization on microbial film in seawater environment[J] . Equip. Environ. Engine., 2004, 1:27 (李相波, 王佳。阴极极化对金属电极表面微生物膜的影响[J] . 装备环境工程, 2004, 1:27)
[30] Dargahi M, Hosseinidoust Z, Tufenkji N, et al. Investigating electrochemical removal of bacterial biofilms from stainless steel substrates[J] , Colloids Surf., B., 2014, 117:152
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414