摘要
通过比较B10铜镍合金在天然海水和含10 mg/L NH4+海水中的腐蚀行为,研究NH4+对B10铜镍合金的腐蚀影响机制。采用失重法测量平均腐蚀速率;采用动电位极化分析、电化学阻抗谱 (EIS) 研究界面腐蚀电化学特征;采用扫描电子显微镜 (SEM) 表征腐蚀产物形貌;采用能量色散光谱 (EDS) 和X射线光电子能谱 (XPS) 分析腐蚀产物成分。结果表明,NH4+的添加降低了腐蚀产物中具有保护作用的Cu2O成分的含量,提高了B10铜镍合金在海水中的腐蚀速率,促进了点蚀的发生。
关键词: NH4+污染 ; 海水 ; B10铜镍合金 ; Cu2O ; 腐蚀产物膜
B10铜镍合金在海水中有着优良的耐腐蚀性能,合金元素Ni、Fe的添加大大增强了合金的抗腐蚀能力[1,2]。B10铜镍合金腐蚀产物中的Cu2O具有较佳的成膜保护性,是铜镍合金优良抗蚀性能的重要原因[3-7]。合金元素Ni通过掺杂到腐蚀产物中具有保护性的Cu2O膜的结构缺陷中,形成了富Ni的表面膜,改变了膜层结构缺陷,提高了膜层与基体的结合力和自愈合能力[8]。B10铜镍合金在海水中的腐蚀速率主要取决于其表面的腐蚀产物膜的性质,B10铜镍合金在海水中的平均腐蚀速率约为6 μm/a[9],凡是能影响其腐蚀产物膜的形成过程、形成速度、膜层成分、结构及保护性能的因素,都能影响铜镍合金在海水中的耐蚀性[11]。
陆源污染向海水中输入大量营养盐,使局部海域如近海港口海水中的无机氮含量远超天然海水数10倍[12,13]。天然海水中NH4+含量平均为0.04 mg/L,很少超过0.40 mg/L[14,15]。本文选用10 mg/L的浓度来研究NH4+污染对B10铜镍合金在海水中腐蚀的影响具备合理性。
关于铵离子对铜合金腐蚀的影响,Pugh等[16]认为NH4+与铜离子组合形成的复合离子导致纯铜在应力条件下发生晶间断裂。Lobnig等[17]研究了硫酸铵对Cu腐蚀的影响,并在腐蚀产物中检测到Cu2O和碱式硫酸铜。Al-Hashem等[18]认为氨和铵盐通过铜离子络合增强了对合金的腐蚀能力。王吉会等[19]认为NH4+的加入使HA177、BFe30两种铜合金的腐蚀速率明显增加,并且加速了腐蚀磨损。张娟等[20]认为当NH4Cl含量高达27 g/L时,铝黄铜在模拟海水中的腐蚀产物中可以检测出铜氨络合物的水合物。
针对B10铜镍合金在天然海水中的腐蚀行为与机理有较为详细的研究,但对于NH4+污染对B10铜镍合金在海水环境下的腐蚀影响则还需要更深入的探讨。因此,本文研究了NH4+污染对B10铜镍合金在海水中的腐蚀影响,以期为B10铜镍合金在类似海水环境下的广泛应用和防腐蚀设计提供参考。
1 实验方法
本文所用B10铜镍合金,化学成分 (质量分数,%) 为:Si 0.15,P 0.02,S 0.02,Zn 0.3,Mn 1.0,Zn 0.15,Ni 10.0,Fe 1.0,Cu余量。
实验海水取自山东青岛沙子口海域,控制腐蚀介质温度为 (25±0.2) ℃,初始pH (7.9±0.1)。向天然海水中加入分析纯NH4Cl得到加NH4+海水,其中NH4+浓度为10 mg/L。失重测试测试周期为30 d,设置3组平行样。除锈处理参照GB/T 16545-2015。
电化学测试使用GAMRY Reference 600型电化学工作站,试样工作面积1 cm2,三电极体系,铂电极作为辅助电极,参比电极为Ag/AgCl/电极。电化学阻抗谱 (EIS) 测试频率范围为105~10-2 Hz,高频向低频扫描,在开路电位基础上施加振幅为10 mV的正弦电压信号。动电位极化曲线扫描范围为开路电位 (OCP)±800 mV,从阴极向阳极扫描,扫描速率为0.334 mV/s。
采用Tescan Vega3扫描电子显微镜 (SEM) 观察试样表面形貌,采用能量色散衍射谱 (EDS) 和Themo-Scientific Escalab 250Xi X射线光电子能谱仪 (XPS) 分析腐蚀产物成分。
2 结果与讨论
2.1 失重测试结果
图1为腐蚀30 d的失重测试结果。由图可知,B10铜镍合金在天然海水中浸泡30 d后的平均腐蚀速率为0.013 g·m-2·h-1,在高NH4+海水中为0.016 g·m-2·h-1。腐蚀30 d时间,NH4+的引入使B10铜镍合金在海水中的平均腐蚀速率上升了23%。
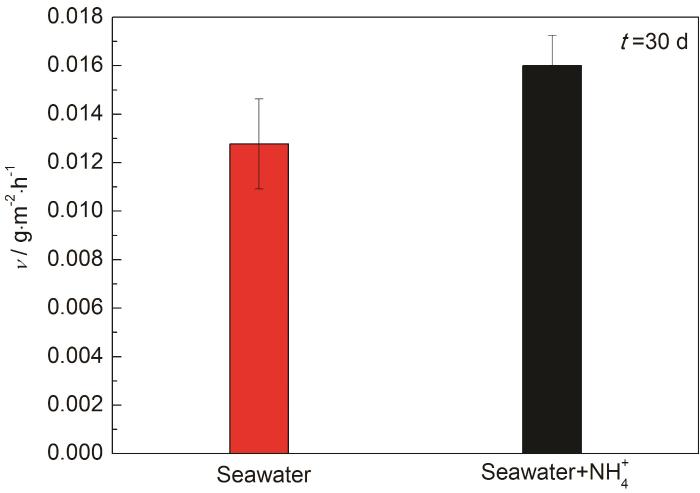
图1 B10铜镍合金在两种海水体系中的腐蚀速率
2.2 电化学实验结果
图2显示了开路电位随时间的变化,由图2可见,两种环境下开路电位都是先降后升,趋势一致但程度不同,说明B10铜镍合金在两种海水体系中,腐蚀的总体规律相似,但腐蚀产物形成时间不同,腐蚀产物的状态也不同。
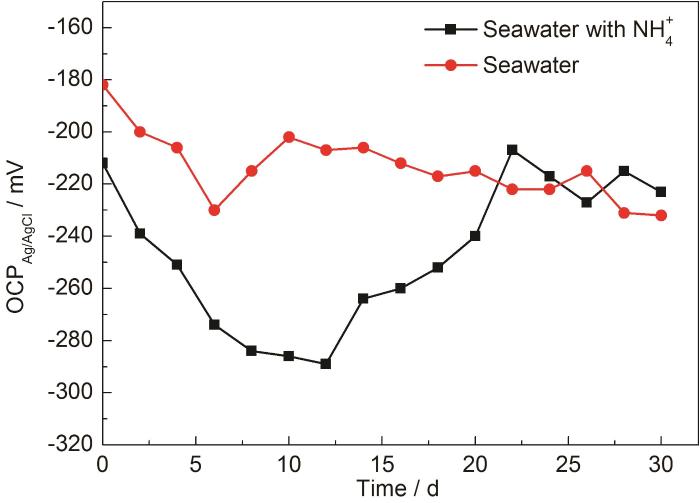
图2 B10铜镍合金在腐蚀介质中的开路电位
图3为B10铜镍合金在海水中的电化学阻抗图,图4为拟合EIS数据所用的等效电路,表1为EIS拟合数据。电化学阻抗谱结果显示NH4+的污染没有改变B10铜镍合金在海水中的腐蚀阶段的规律,30 d的周期内腐蚀都是先减缓后加速最后趋于平稳。这与开路电位的变化规律具有一致性,对应了铜镍合金在海水环境下保护性腐蚀产物膜的形成和后期的弱化失效。对比加NH4+前后的容抗弧半径,可见加NH4+情况下容抗弧半径明显小于天然海水,说明NH4+的加入加速了腐蚀。由图3b可知高NH4+海水中模值斜率总体更小,说明NH4+的加入降低了腐蚀产物层的致密性。B10铜镍合金在天然海水中的相位角峰较宽,存在两个表观时间常数,但不明显,而在含NH4+海水中的相位角图出现两个明显的时间常数,并且在高NH4+海水中可见两个更加明显的时间常数,说明NH4+的存在令腐蚀产物膜与基体的区分更加显著。
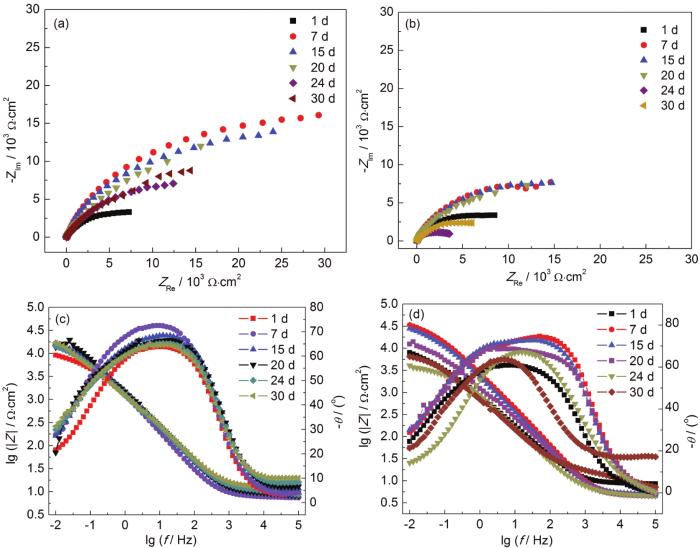
图3 B10铜镍合金在腐蚀介质中的电化学阻抗图
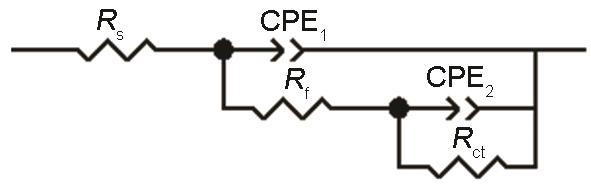
图4 模拟符合EIS数据的等效电路的物理模型
表1 B10铜镍合金在腐蚀介质中的EIS拟合数据
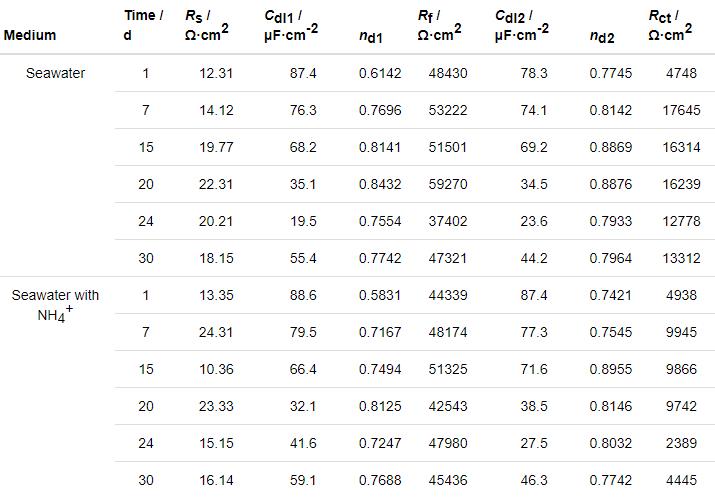
图5为B10铜镍合金在两种海水体系中的极化曲线。由图可见,加入NH4+并未改变B10铜镍合金的自腐蚀电位,两种体系下,阳极极化曲线均具有明显的3个氧化峰,推测包含3个阳极反应过程,且在较高阳极极化电位下,有非典型“钝化”行为,说明阳极反应产物覆盖在B10铜镍合金表面,阻止了腐蚀。
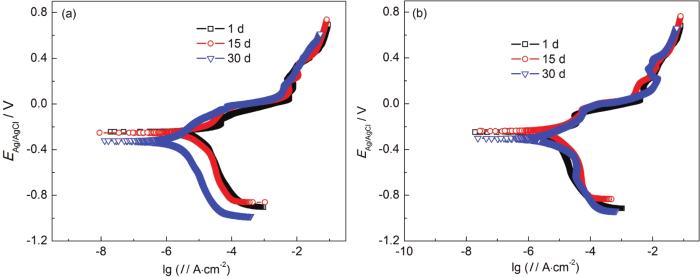
图5 B10铜镍合金在两种海水体系中的极化曲线
极化曲线的拟合数据显示,B10铜镍合金在加NH4+海水中始终具有更高的自腐蚀电流密度,这体现了NH4+对B10铜镍合金腐蚀的促进作用,与前文的实验结果是一致的。
表2 B10铜镍合金极化曲线拟合数据
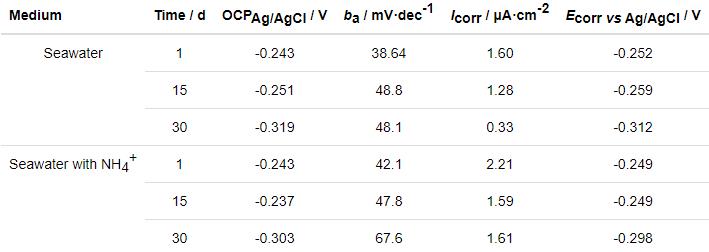
2.3 腐蚀产物形貌表征和成分分析
2.3.1 SEM观察
图6a和b为B10铜镍合金腐蚀30 d腐蚀产物和除锈基底的表面形貌图,可见两种环境下表面均有较多腐蚀产物,且由于表面失水,可见皲裂细纹。去除腐蚀产物后,由图6c和d可以明显看出高NH4+环境下B10铜镍合金表面点蚀、蚀坑数量多,局部腐蚀更严重。说明NH4+的存在促进了B10铜镍合金的局部腐蚀。

图6 B10铜镍合金在腐蚀介质中腐蚀30 d后腐蚀产物和除锈基底的SEM像
2.3.2 EDS成分分析结果
图7为B10铜镍合金在两种海水体系浸泡30 d腐蚀产物的EDS谱图,表3为B10铜镍合金在两种海水体系中浸泡30 d腐蚀产物的EDS数据。可知,B10铜镍合金在两种海水体系中的腐蚀产物组成元素主要为O、Cu、Ni,元素含量占比相差不大。此外还检测出S、Cl、Mn、Fe等少量元素,这些元素可能来自合金组分或者海水中。未检测出N,可能是因为NH4+参与反应的腐蚀产物溶于海水因而未在产物中显现。
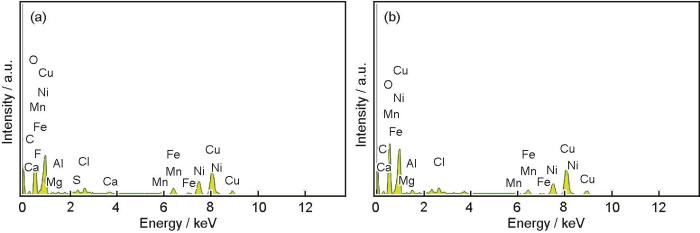
图7 B10铜镍合金在两种海水体系中浸泡30 d后腐蚀产物的EDS谱
表3 B10铜镍合金在两种海水体系中浸泡30 d后的EDS结果
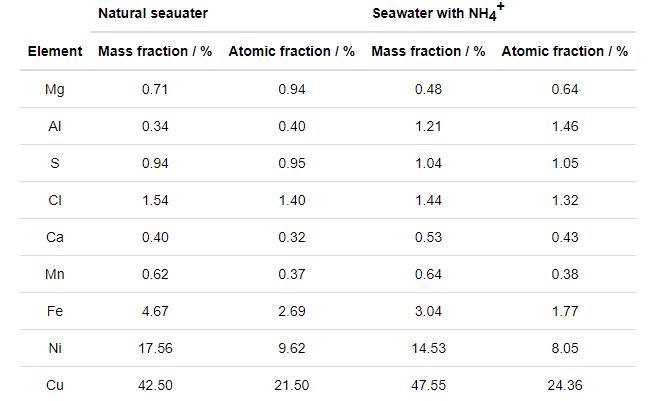
2.3.3 XPS成分分析
图8为B10铜镍合金在腐蚀介质中浸泡30 d腐蚀产物的XPS谱图。XPS元素结合能数据以284.8 eV处的C—C键为参考进行分峰拟合,产物的定量结果如图9所示。两种环境下腐蚀产物种类一致,Cu、O、Ni在腐蚀产物中的主要存在形式都是CuO、Cu2O、NiO、Ni(OH)2。差别在于腐蚀产物中Cu2O的含量上,NH4+浓度升高后Cu2O在Cu的氧化物中占比从37%下降为22%。由此可见,NH4+的加入显著降低了Cu2O在腐蚀产物中的含量,进而促进了B10铜镍合金的腐蚀。

图8 B10铜镍合金在天然海水和含NH4+海水中浸泡30 d后腐蚀产物的XPS谱
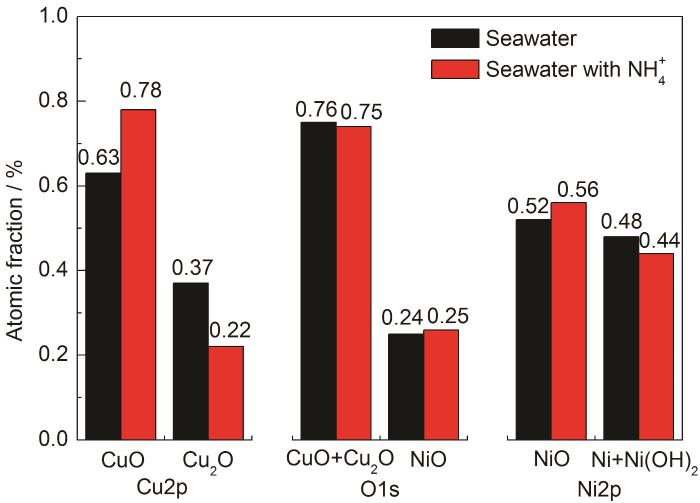
图9 XPS谱对应的化合物占比图
2.4 海水中NH4+对B10铜镍合金腐蚀影响机理讨论
从Ni2+的配位性质可知,在NH4+浓度为10 mg/L 的条件下,配离子[Ni(NH3)6]2+不易生成,Ni(OH)2是其稳定存在形式[22]。
B10铜镍合金在腐蚀前期的两个过程,分别是保护性钝化膜的建立和Cl-等侵蚀性离子的吸附和侵蚀。反应 (1) 是体系中最主要的阴极去极化过程,反应 (2) 体现了Cl-对阳极过程的促进作用。反应 (3) 体现了Cu2O薄膜的建立,该膜具有高致密性,随着其完整度越来越高逐渐发挥出色的保护作用,这也是Cu合金抗蚀性能的主要来源。反应 (4) 是CuO的生成过程,CuO层位于Cu2O层之上,相较疏松。
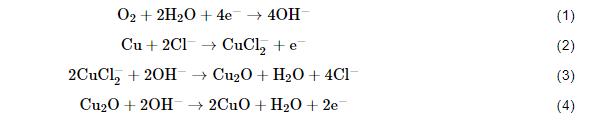
反应 (5) 和 (6) 反映了NH4+通过消耗Cu2O生成配离子,削弱Cu2O膜的致密性和完整性。
反应 (6) 的存在会令Cu2O膜-保护膜减薄和产生裂纹/缺陷,导致其保护性能大打折扣。同时,反应 (7) 会消耗界面附近的O2,从而还会抑制Cu2O膜的修复。总的来说,NH4+对腐蚀产物中的Cu2O保护膜具有针对性的破坏作用。NH4+促进该合金的腐蚀作用机理可解释为:一方面NH4+与铜离子形成铜氨络合物,促进了Cu失电子过程,另一方面NH4+的存在使保护性产物Cu2O减少。
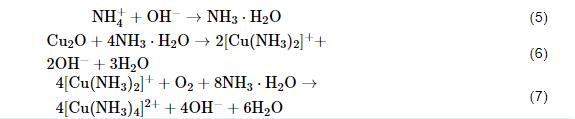
3 结论
(1) NH4+对B10铜镍合金在海水的腐蚀具有促进作用,促进了B10铜镍合金产生局部腐蚀,主要表现为点蚀。
(2) 在含NH4+海水中,B10铜镍合金表面的腐蚀产物主要为Cu和Ni的氧化物CuO、Cu2O、NiO,但具有保护作用的Cu2O占比小。NH4+对腐蚀产物中的Cu2O保护膜具有针对性的破坏作用。
参考文献
1 Liu T J, Chen H P, Zhang W F, et al. Accelerated corrosion behavior of B10 Cu-Ni alloy in seawater [J] J. Mater. Eng., 2017, 45(5): 31
1 刘天娇, 陈惠鹏, 张卫方等. B10铜镍合金海水加速腐蚀行为 [J]. 材料工程, 2017, 45(5): 31
2 Shi Z Y, Liu B, Liu Y, et al. Progress of corrosion behavior and anti-corrosion technology for typical copper-nickel alloys under marine environment [J]. Equip. Environ. Eng., 2020, 17(8): 38
2 石泽耀, 刘斌, 刘岩等. 典型铜镍合金在海洋环境中腐蚀行为与防护技术研究进展 [J]. 装备环境工程, 2020, 17(8): 38
3 Zhu X L, Lin L Y, Lei T Q. Review on corrosion behaviors of Cu-Ni alloys in seawater [J]. Corros. Sci. Prot. Technol., 1997, 9(1): 48
3 朱小龙, 林乐耘, 雷廷权. Cu-Ni合金海水腐蚀行为研究进展 [J]. 腐蚀科学与防护技术, 1997, 9(1): 48
4 Yang B J, Chen X F, Yao J H, et al. Corrosion behavior of copper and its alloys in freshwater-seawater alternate circumstance [J]. Equip. Environ. Eng., 2017, 14(2): 24
4 杨博均, 陈翔峰, 姚敬华等. 铜及铜合金在淡海水交替自然环境条件下的腐蚀行为研究 [J]. 装备环境工程, 2017, 14(2): 24
5 Chen H Y, Zhu Y L. Selective corrosion of BFe10-1-1 alloy in NaCl solution [J]. Corros. Prot., 2006, 27: 404
5 陈海燕, 朱有兰. B10铜镍合金在NaCl溶液中腐蚀行为的研究 [J]. 腐蚀与防护, 2006, 27: 404
6 Dowsett M, Adriaens A, Martin C, et al. The use of synchrotron X-rays to observe copper corrosion in real time [J]. Anal. Chem., 2012, 84: 4866
7 Ji S Y, Wang C G, Cai W, et al. Corrosion mechanism of Cu-Ni alloy cooler at Xiluodu hydropower station [J]. Mech. Electr. Tech. Hydro. Sta., 2019, 42(7): 71
7 姬升阳, 王长罡, 蔡伟等. 溪洛渡水电站铜镍合金冷却器腐蚀机理研究 [J]. 水电站机电技术, 2019, 42(7): 71
8 Cheng D B, Guo Y, Liu X H, et al. Studies on corrosion and protection of heat exchange tubes of B30 copper-nickel alloy [J]. Dev. Appl. Mater., 2020, 35(1): 84
8 程德彬, 郭悦, 刘雪辉等. B30铜镍合金换热管腐蚀与防护研究进展 [J]. 材料开发与应用, 2020, 35(1): 84
9 Zhao Y H, Lin L Y, Cui D W. Localized corrosion of copper and its alloys in seawater at four test sits along china coast for 16 years [J]. Corros. Sci. Prot. Technol., 2003, 15: 266
9 赵月红, 林乐耘, 崔大为. 铜及铜合金在我国实海海域暴露16年局部腐蚀规律 [J]. 腐蚀科学与防护技术, 2003, 15: 266
10 Zhu X L, Li Z J, Xu J. Progress in research on formation and rupture mechanism of Seawater corrosion products of Cu-NI alloy [J]. Chin. J. Rare Met., 1997, 21(6): 463
10 朱小龙, 李中建, 徐杰. Cu-Ni合金海水腐蚀产物膜的形成与破裂机制研究进展 [J]. 稀有金属, 1997, 21(6): 463
11 Wu Q M, Chen S Z, Yu Z G, et al. Dissolved inorganic nitrogen in the Southern Yellow Sea [J]. J. Ocean Univ. Qingdao, 2001, 31: 129
11 吴强明, 陈淑珠, 于志刚等. 黄海南部的溶解无机氮 [J]. 青岛海洋大学学报 (自然科学版), 2001, 31: 129
12 Sun P X, Wang Z L, Zhan R, et al. Study on dissolved inorganic nitrogen distributions and eutrophication in the Jiaozhou bay [J]. Adv. Mar. Sci., 2005, 23: 466
12 孙丕喜, 王宗灵, 战闰等. 胶州湾海水中无机氮的分布与富营养化研究 [J]. 海洋科学进展, 2005, 23: 466
13 Zhao X D, Zhu C J, Ju P, et al. The forms and distributions of nitrogen of seawater in eastern Jiaozhou bay [J]. Mar. Sci., 1998, 12 (1): 3
13 赵夕旦, 祝陈坚, 举鹏等. 胶州湾东部海水中氮的含量和分布 [J]. 海洋科学, 1998, 12(1): 3
14 Zhang Z B, Liu L S. Marine Chemistry Marine Chemistry [M]. Ji’nan: Shandong Education Press, 2004
14 张正斌, 刘莲生. 海洋化学 [M]. 济南: 山东教育出版社, 2004
15 Yu H, Ding L, Liu S W, et al. Research progress on determination of ammonia nitrogen in seawater [J]. Chem. Bioeng., 2017, 34(5): 1
15 于涵, 丁兰, 刘淑文等. 海水氨氮检测技术研究进展 [J]. 化学与生物工程, 2017, 34(5): 1
16 Pugh E N, Montague W G, Westwood A R C. Stress-corrosion cracking of copper [J]. Corros. Sci., 1966, 6: 345
17 Lobnig R E, Frankenthal R P, Siconolfi D J, et al. The effect of submicron ammonium sulfate particles on the corrosion of copper [J]. J. Electrochem. Soc., 1993, 140: 1902
18 Al-Hashem A, Carew J. The use of electrochemical impedance spectroscopy to study the effect of chlorine and ammonia residuals on the corrosion of copper-based and nickel-based alloys in seawater [J]. Desalination, 2002, 150: 255
19 Wang J H, Jiang X X, Li S Z. Corrosion wear behavior of copper alloys in 3.5%NaCl+NH3(NH4+) solution [J]. Acta Metall. Sin., 1997, 33(12): 1268
19 王吉会, 姜晓霞, 李诗卓. 铜合金在3.5%NaCl+NH3(NH4+) 溶液中的腐蚀磨损行为 [J]. 金属学报, 1997, 33(12): 1268
20 Zhang J, Li Z, Tang N, et al. Study on corrosion behavior of rare-earth aluminum brass in NaCl+NH4Cl solution [J]. Trans. Mater. Heat Treat., 2009, 30(1): 104
20 张娟, 李周, 唐宁等. 稀土铝黄铜合金在NaCl+NH4Cl腐蚀液中的腐蚀行为 [J]. 材料热处理学报, 2009, 30(1): 104
21 Huang G S, Liu G Z, Duan D X, et al. Effects of ammonia producing bacteria on corrosion of B30 [J]. Corros. Prot., 2005, 26 (8): 333
21 黄国胜, 刘光洲, 段东霞等. 产氨菌对B30铜镍合金腐蚀的影响 [J]. 腐蚀与防护, 2005, 26(8): 333
22 Cartere T W, Verley K S. Coordination Chemistry Research Progress [M]. Hauppauge, NY: Nova Science Publishers, 2008
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





