摘要
采用干/湿交替的实验方法模拟大气腐蚀过程。运用X射线衍射、3D激光测量显微镜、电化学阻抗谱以及极化曲线等手段,研究了O3/SO2复合大气环境中Q235B钢的腐蚀演化特性。结果表明,O3和SO2的交互作用对Q235B钢的腐蚀有明显的抑制作用。腐蚀演化特性方面,当模拟环境中Na2SO3浓度为0.01 mol/L时,O3/SO2复合大气环境中Q235B钢的腐蚀速率呈先迅速增大而后缓慢减小的趋势; 当模拟环境中Na2SO3浓度为0.05 mol/L时,O3/SO2复合大气环境中Q235B钢的腐蚀速率呈先缓慢增大后迅速下降的趋势; 当模拟环境中Na2SO3浓度为0.10 mol/L时,O3/SO2复合大气环境中Q235B钢的腐蚀速率呈先增大而后缓慢减小的趋势。相比于不含O3的大气环境,当模拟大气中SO2含量较低时,O3和SO2的交互作用会促进具有保护性腐蚀产物中α-FeOOH生成;而当大气中SO2含量较高时,O3对腐蚀产物相组成影响不明显。
关键词: Q235B钢 ; O3 ; 大气腐蚀 ; 腐蚀产物
钢铁的大气腐蚀是指钢铁表面与其周围大气环境之间发生的涉及多种气象因素、多种污染物组分参与、以及界面经历干/湿交替变化并伴有腐蚀产物生成的多种物理化学过程的综合体现,该腐蚀过程会受大气中的各种污染气体在表面薄液膜中溶解的影响[1-3]。因此,研究多环境因素交互作用下钢铁的大气腐蚀演化特征与机制十分必要。
钢铁的大气腐蚀环境按空气中腐蚀性介质的种类与含量的不同可以分为工业大气 (腐蚀性介质主要为SO2)、海岸大气 (腐蚀性介质主要为Cl-)、工业-海岸大气、城市大气和乡村田园大气等[4,5]。在海岸大气中,Cl-对钢铁腐蚀影响的研究已经较为成熟,学术界普遍认为起到促进作用。Henriksen等[6]研究表明:NaCl先从空气中吸收水分,然后在钢表面发生O2的去极化,从而促进了钢的腐蚀。文献[1,7]认为在海岸大气中由于Cl-体积较小,可以穿透腐蚀产物层到达钢铁表面诱发腐蚀。文献[8,9]表明在Cl-浓度低的地方有利于生成α-FeOOH和γ-FeOOH;在Cl-浓度高的地方更易于生成β-FeOOH。在工业大气中,SO2对钢铁腐蚀的影响更为复杂。Evans等[10,11]研究表明,SO2可引起“酸的再生循环”,从而加速钢铁腐蚀。而Leygraf等[12]则认为,具有保护性的α-FeOOH更容易在SO2浓度较高的大气中生成,从而又起到延缓钢铁腐蚀的作用。Allam等[13]认为在腐蚀初期Cl-因侵蚀性较强而起主导作用,而在腐蚀后期SO2又成了促进腐蚀的首要因素。Asami等[14]通过对日本四日市 (工业-海岸大气地区) 17年的大气腐蚀曝晒实验研究表明,普通碳钢和耐候钢的铁锈均由α-FeOOH、β-FeOOH、γ-FeOOH、Fe3O4以及非晶组成。但Wang等[15]在青岛 (工业-海岸大气地区) 的钢曝晒实验中并没有检测到明显的β-FeOOH,这应该是由于四日市和青岛两地区的SO2浓度不同所造成的。陈文娟等[4,5]研究认为,在Cl-和SO2交互作用的工业-海岸大气中,当SO2浓度较低时,钢铁遵循只含Cl-大气环境的腐蚀特性;当SO2浓度较高时,钢铁遵循只含SO2大气环境的腐蚀特性。王振尧等[16]研究表明,SO2和Cl-的协同效应会加速碳钢的腐蚀,但二者比例的变化对碳钢腐蚀失重及腐蚀产物成分的影响并不明显。
近几年来,大气中的次生污染物 (如O3等) 的浓度逐渐上升[17-21],含有O3的大气腐蚀体系成为了大气腐蚀领域新的研究热点。Wiesinger等[22]研究了在一定相对湿度 (0%、50%和90%) 的大气环境中,高纯多晶银样品与臭氧的相互作用,认为氧化物的形成和腐蚀速率取决于大气中的相对湿度,表明在50%相对湿度时O3对银具有强烈的腐蚀作用。Augusto等[23]认为,在意大利空气中O3的浓度已达到导致石灰石和Cu发生腐蚀的临界浓度。Oesch等[24]研究表明,O3对Cu腐蚀的促进作用要强于SO2和NO2。陈文娟等[25]研究表明,O3和Cl-的交互作用对Q235B钢的腐蚀有明显的促进作用。Aastrup等[26]研究表明,当O3与SO2联合作用时,会明显增加Cu的腐蚀速率。而O3与SO2联合作用对低碳钢腐蚀的影响还有待进一步探索。
本工作采用实验室模拟大气腐蚀干/湿交替实验 (CCT)[27-29]的方法,结合电化学测量、3D激光测量显微镜以及X射线衍射 (XRD) 等手段,研究了O3/SO2复合大气环境下,低碳钢的腐蚀速率、腐蚀演化特性、腐蚀产物相组成及腐蚀机理。
1 实验方法
实验材料为Q235B钢,其化学成分 (质量分数,%) 为:C 0.210,Si 0.210,Mn 0.580,S 0.036,P 0.017,Cu 0.020,Fe为余量。采用精密线切割机床对钢材进行线切割,得到尺寸为30 mm×30 mm×5 mm的实验样品供干/湿交替腐蚀增重实验和腐蚀产物分析用,尺寸为10 mm×10 mm×1 mm的实验样品供阻抗谱、极化曲线以及3D激光测量显微镜测量用。干/湿交替腐蚀增重实验[25,27]的流程为:(1) 采用分析天平称量样品的初始质量;(2) 往实验样品表面按40 μL/cm2滴加腐蚀溶液,并使其铺展均匀;(3) 设定HWS-70BX恒温恒湿实验箱内的温度和相对湿度分别为30 ℃和60%。当箱内的温度、相对湿度以及O3浓度稳定后,放置实验样品于实验箱内至设定的时间 (12 h);(4) 样品干燥后取出实验样品再次称重;(5) 用蒸馏水洗盐以避免盐粒在样品表面上聚集。以上为1个腐蚀周期 (1 CCT);(6) 样品表面干燥之后,重复第2~5步直到设定的干/湿交替周次。每种环境的腐蚀增重实验均采用3个平行样品,并分别进行称量,之后用3者的平均值绘制出腐蚀增重随腐蚀周期变化的曲线。模拟大气所用电解质溶液采用不同浓度的Na2SO3溶液,O3由臭氧发生器 (AZ-1000MG-G) 产生。每次模拟环境中Na2SO3的浓度和O3的含量如表1所示。实验所用溶液均采用分析纯试剂和去离子水配制。
表1 模拟大气环境中Na2SO3的浓度和O3的含量
采用DX-2700B X射线衍射 (XRD) 分析经过不同时间腐蚀后得到的腐蚀产物相组成。粉末样品的制备过程是:将钢铁样品表面锈层刮下,研磨后制成粉末样品。衍射测量时扫描速度为2°/min。采用对比XRD结果中各个相的相对峰强进行相组成的半定量分析[25,27]。采用VK-X2503D激光测量显微镜,观察材料表面轮廓并进行形状的三维测试与定量分析。
采用CS310电化学工作站进行电化学测试,采用三电极体系,工作电极为不同干/湿交替周次腐蚀后的带锈钢样;辅助电极为4 cm2的Pt片;参比电极为饱和甘汞电极 (SCE)。溶液与参比电极之间采用鲁金毛细管相连,鲁金毛细管口靠近工作电极表面 (约1 mm距离),以减小溶液欧姆电位降。工作温度为室温 (25 °C),所有的电位值均是相对于饱和甘汞电极的电位。实验过程中所用的电解液分别为各自的模拟大气腐蚀的溶液。电化学阻抗谱 (EIS) 的频率范围为105~10-2 Hz,测试时施加的扰动交流电位幅度为10 mV。动电位极化曲线扫描电位范围为±0.3 V vsEcorr (相对于自腐蚀电位),扫描速度为0.1 mV/s。
2 实验结果
2.1 腐蚀动力学
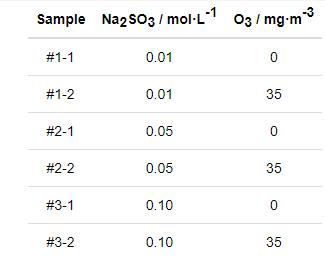
图1所示为Q235B钢在6种模拟大气环境中的腐蚀增重曲线。可见,在所有模拟环境中钢的腐蚀增重随干/湿交替次数增加而增大。当模拟环境中Na2SO3浓度相同时,Q235B钢在O3/SO2复合大气环境中的腐蚀增重均明显小于仅含SO2的大气环境中的腐蚀增重。这说明O3和SO2的交互作用抑制了Q235B钢的大气腐蚀。此外,对比图1a~c还可以看出,在O3/SO2复合大气环境中,Q235B钢的腐蚀增重随着SO2浓度的升高而逐渐增大。
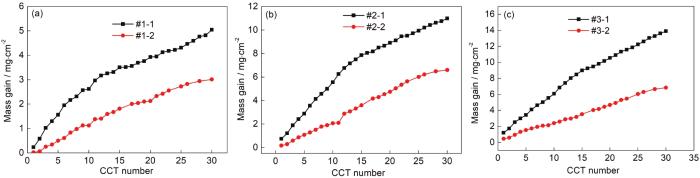
图1 Q235钢模拟大气环境中低碳钢的腐蚀增重曲线
钢铁大气腐蚀动力学符合幂函数规律如式 (1) 所示[1,2],其中W为单位面积的腐蚀增重,N为干/湿交替腐蚀周期数 (CCT次数),A和n为常数。从式 (1) 可以得到腐蚀速率公式 (2):

对6种模拟环境中的腐蚀增重曲线依次进行分段拟合得到腐蚀速率随干/湿交替次数变化的曲线如图2所示。图2a表明,当模拟环境中Na2SO3浓度为0.01 mol/L时,腐蚀速率变化规律为:仅含SO2的大气环境中Q235B钢的腐蚀速率呈先迅速增大后又急剧减小的趋势;O3/SO2复合大气环境中Q235B钢的腐蚀速率呈先迅速增大而后缓慢减小的趋势。对比两条腐蚀速率曲线还可以发现,在20 CCT之前O3/SO2复合大气环境中低碳钢的腐蚀速率均明显低于仅含SO2的大气环境中低碳钢的腐蚀速率;在20 CCT之后O3/SO2复合大气环境中低碳钢的腐蚀速率略高于仅含SO2的大气环境中低碳钢的腐蚀速率。图3b表明,当模拟环境中Na2SO3浓度为0.05 mol/L时,腐蚀速率变化规律为:仅含SO2的大气环境中Q235B钢的腐蚀速率呈逐渐减小的趋势;O3/SO2复合大气环境中Q235B钢的腐蚀速率基本呈先缓慢增大后下降的趋势。对比两条腐蚀速率曲线还可以发现,在15CCT之前O3/SO2复合大气环境中低碳钢的腐蚀速率均明显低于仅含SO2的大气环境中低碳钢的腐蚀速率;在16~25 CCT,O3/SO2复合大气环境中低碳钢的腐蚀速率略高于仅含SO2的大气环境中低碳钢的腐蚀速率;在26 CCT之后,O3/SO2复合大气环境中低碳钢的腐蚀速率远低于仅含SO2的大气环境中低碳钢的腐蚀速率。这说明此大气环境中O3和SO2的交互作用可以抑制钢铁的腐蚀。图3c表明,当模拟环境中Na2SO3浓度为0.10 mol/L时,腐蚀速率变化规律为:仅含SO2的大气环境中Q235B钢的腐蚀速率呈逐渐减小的趋势;O3/SO2复合大气环境中Q235B钢的腐蚀速率呈先增大而后缓慢减小的趋势。对比两条腐蚀速率曲线还可以发现,在整个腐蚀过程中,O3/SO2复合大气环境中低碳钢的腐蚀速率均明显低于仅含SO2的大气环境中低碳钢的腐蚀速率,这也说明此大气环境中O3和SO2的交互作用可以抑制钢铁的腐蚀。此外,从图3a~c可以看出,Q235B钢的腐蚀速率逐渐增加。这表明,随着大气环境中SO2含量的增加,O3/SO2复合大气环境对低碳钢的腐蚀抑制作用越来越明显。
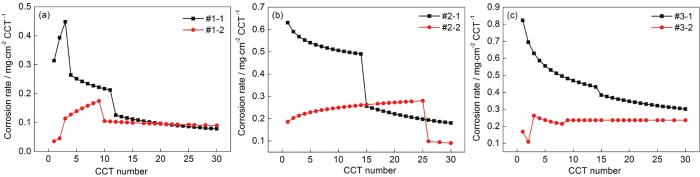
图2 Q235B钢在模拟大气中腐蚀速率随干/湿交替次数变化的曲线
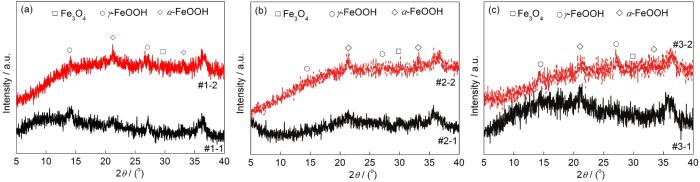
图3 Q235B钢在模拟大气中经过30 CCT后腐蚀产物的XRD谱
2.2 锈层相组成
图3为Q235B钢在不同模拟液环境中经干/湿交替腐蚀30 CCT后腐蚀产物的XRD谱。图3a表明,当模拟环境中SO2浓度为0.01 mol/L时,腐蚀产物均主要由α-FeOOH和γ-FeOOH组成。此外还可以看出,在此SO2浓度的模拟环境中O3和SO2的交互作用会抑制γ-FeOOH的生成,同时促进α-FeOOH的生成。图3b表明,当模拟环境中SO2浓度为0.05 mol/L时,腐蚀产物主要由α-FeOOH和少量的γ-FeOOH和Fe3O4组成。此外还可以看出,与仅含SO2的大气环境相比,O3/SO2复合大气环境下锈层相组成中α-FeOOH的衍射峰相对强度较高,而Fe3O4的衍射峰相对强度较弱,说明在此SO2浓度的大气环境中O3和SO2的交互作用会促进α-FeOOH同时抑制Fe3O4的生成。图3c表明,当模拟环境中SO2浓度为0.10 mol/L时,腐蚀产物均主要由α-FeOOH和γ-FeOOH组成。O3和SO2的交互作用对腐蚀产物的影响不明显。
以上结果表明,当模拟大气中SO2含量较低时,O3和SO2的交互作用有利于具有保护性腐蚀产物中α-FeOOH生成;而当大气中SO2含量较高时,O3和SO2的交互作用对腐蚀产物相组成影响不明显。
2.3 锈层电化学性质
图4为经过不同干/湿循环次数腐蚀后的Q235B钢带锈电极在大气模拟环境中的极化曲线。当模拟环境中SO2浓度为0.01 mol/L时,带锈电极极化曲线的变化规律为:如图4a1所示,在仅含SO2的大气环境中带锈电极的腐蚀电位从1 CCT至30 CCT正移,阴极和阳极电流密度增加,这意味着随着腐蚀的进行促进了阴极和阳极的反应过程;如图4a2所示,在O3/SO2复合大气环境腐蚀过程中,带锈电极腐蚀电位以及阴极和阳极电流密度随着腐蚀时间延长逐渐波动,这可能是由于腐蚀过程中锈层交替开裂与修复所造成的。当模拟环境中SO2浓度为0.05 mol/L时,带锈电极极化曲线的变化规律为:如图4b1所示,在仅含SO2的大气环境中带锈电极极化曲线的变化规律与图4a2所示相似;如图4b2所示,在O3/SO2复合大气环境中带锈电极的腐蚀电位从1 CCT至10 CCT正移,阴极和阳极电流密度增加,这意味着随着腐蚀的进行促进了阴极和阳极的反应过程,而在10 CCT之后腐蚀电位、阴阳极电流密度基本稳定。当模拟环境中SO2浓度为0.10 mol/L时,带锈电极极化曲线的变化规律为:如图4c1所示,在仅含SO2的大气环境中带锈电极极化曲线的变化规律与图4a2所示相似;如图4c2所示,在O3/SO2复合大气环境中带锈电极在整个30 CCT的腐蚀过程中腐蚀电位变化不大,阴极和阳极电流密度略有波动。
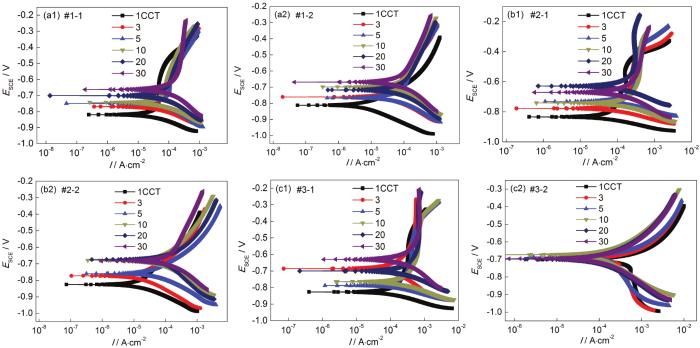
图4 大气环境中带锈电极的极化曲线结果
Icorr与极化电阻Rp之间的关系可以用Stern公式[31]表示:

式中B为常数,其值取决于阴、阳极反应过程的动力学常数的大小。当腐蚀过程是受电极/溶液界面的电荷转移控制时,腐蚀的阳极溶解过程与阴极还原过程遵循Tafel关系式:

式中,βa和βc分别为阳极和阴极反应的Tafel斜率,其中阴极Tafel斜率βc为负数。然而,当腐蚀过程由阴极还原的扩散过程控制时,βc为负无穷 (-∞),B可以表示为:

此外,βa值的范围为13~52 mV,βc值通常小于-52 mV。如果βa为52 mV,βc为-52 mV,得到B为26 mV。如果βa为13 mV,βc为-52 mV,得到B为10 mV。此外,当βc为负无穷 (-∞) 时,得到B为52 mV。所以,B值的范围为10~52 mV。目前的研究表明,带锈电极的阴极过程不仅包含溶解氧的还原还有腐蚀产物的还原,因而在本文中B值假设为17 mV[5]。
图5为对图4进行线性拟合得到的Icorr随干/湿交替周次变化的曲线。当模拟环境中SO2浓度为0.01 mol/L时,如图5a所示,带锈电极腐蚀电流密度的变化规律为:在仅含SO2的大气环境中电极的腐蚀电流密度先增大,后缓慢下降,之后略有升高;在O3/SO2复合大气环境电极的腐蚀电流密度先增大,后缓慢下降;通过对比两条曲线发现,在O3/SO2复合大气环境电极的腐蚀电流密度总体低于仅含SO2的大气环境中电极的腐蚀电流密度。当模拟环境中SO2浓度为0.05 mol/L时,如图5b所示,带锈电极腐蚀电流密度的变化规律为:在仅含SO2的大气环境中电极的腐蚀电流密度先增大,后下降;在O3/SO2复合大气环境电极的腐蚀电流密度呈逐渐增大的趋势;通过对比两条曲线发现,在O3/SO2复合大气环境电极的腐蚀电流密度低于仅含SO2的大气环境中电极的腐蚀电流密度。当模拟环境中SO2浓度为0.10 mol/L时,如图5c所示,带锈电极腐蚀电流密度的变化规律为:在仅含SO2的大气环境中电极的腐蚀电流密度先增大,后下降;在O3/SO2复合大气环境电极的腐蚀电流密度呈先减小之后基本稳定的趋势;通过对比两条曲线发现,在O3/SO2复合大气环境电极的腐蚀电流密度在腐蚀初期高于仅含SO2的大气环境中电极的腐蚀电流密度,之后又低于仅含SO2的大气环境中电极的腐蚀电流密度。以上表明腐蚀电流密度曲线与腐蚀动力学规律基本一致,在这3种不同浓度的SO2的大气环境中,O3和SO2的交互作用会起到抑制低碳钢腐蚀的作用。
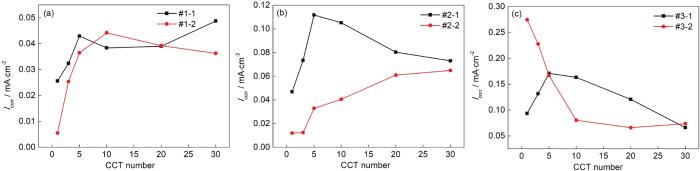
图5 Q235B钢样品在模拟大气中经过不同干/湿交替周次腐蚀后的带锈电极极化电阻曲线
图6为经干/湿循环腐蚀作用后Q235B钢带锈电极在各自模拟溶液中EIS的Bode图。在整个腐蚀过程中频率-相角图均呈现2个峰和1个谷。其中,高频峰是由饱和甘汞电极与测试用电解质溶液间产生的高频相移造成的,低频峰主要与锈层的状态和性质相关[32,33]。图6显示,在不同模拟大气环境中,低频区 (0.01 Hz) 和高频区 (104 Hz) 的阻抗模值均随干/湿交替次数的增加基本呈不断波动的趋势,表明随着腐蚀时间的延长,锈层与钢基体间的界面结构处于不稳定状态。
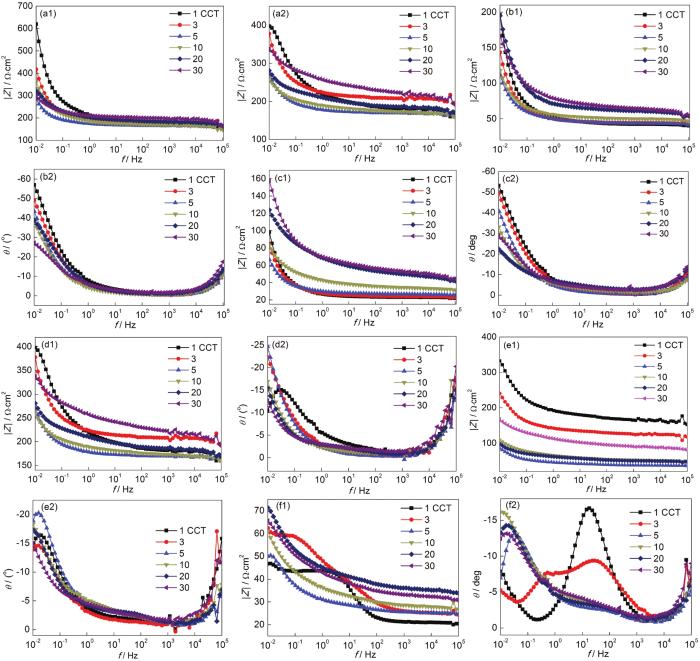
图6 Q235B 钢带锈电极在大气模拟液中的Bode图
图7所示为拟合图6中各个EIS用的等效电路,其中,Rs,Rr,Rct分别代表溶液电阻,锈层电阻和电荷转移电阻;常相位角元件Qp,Qr和Qdl分别代表高频相移电容,锈层电容和双电层电容;ZW为扩散阻抗,ZW的值依赖于角频率ω:
图7 拟合模拟大气中带锈电极的电化学阻抗谱的等效电路

其中,Yw是常数,j是虚数单位。Yw值越大,表明介质的扩散阻力越小。对于带锈电极而言,Yw值越大,锈层对扩散传质的阻挡能力越弱,表明锈层的致密性越差。
图8a1~c3分别为拟合EIS图谱得到的Rr,Rct以及Yw随干/湿交替周次变化的曲线,拟合过程中的统计方差均小于10-4。图8a1和b1显示,当模拟环境中SO2浓度为0.01和0.05 mol/L时,在这4种模拟环境中Rr值均随干/湿交替周次的增加而不断波动,这表明随着时间的延长锈层生成/开裂交替进行。图8c1显示,当模拟环境中SO2浓度为0.10 mol/L时,在这2种模拟环境中Rr值均随干/湿交替周次的增加而增大,这表明随着时间的延长锈层在不断增厚。图8a2表明,当模拟环境中SO2浓度分别为0.01 mol/L时,在仅含SO2的大气和O3/SO2复合大气环境中Rct值均随干/湿交替周次的增加而呈逐渐减小后基本稳定的趋势,表明电荷转移过程在初期更容易,之后达到稳定状态。图8b2表明,当模拟环境中SO2浓度分别为0.05 mol/L时,在仅含SO2的大气环境中Rct值随干/湿交替周次的增加而呈先增大后减小的趋势;在O3/SO2复合大气环境中Rct值随干/湿交替周次的增加而呈逐渐减小后增大的趋势。图8c2表明,当模拟环境中SO2浓度为0.10 mol/L时,在仅含SO2的大气和O3/SO2复合大气环境中Rct值随干/湿交替周次的增加而呈逐渐增大的趋势,表明电荷转移过程变得越来越困难。从图8a2,b2和c2还可以看出,在整个腐蚀过程中在O3/SO2复合大气环境中Rct值基本均比在仅含SO2的大气环境中大。此外,对比图8a2,b2和c2可以看出,在O3/SO2复合大气环境中,随着模拟环境SO2含量的升高Rct值逐渐减小。因为腐蚀速率与Rct成反比[31],Rct越大则表明其腐蚀速率越小,因而图8a2,b2和c2中Rct值随SO2浓度变化规律与图2所示的腐蚀速率曲线结果基本一致。图8a2,b2和c2表明,当模拟环境中SO2浓度分别为0.01,0.05以及0.10 mol/L时,在仅含SO2的大气和O3/SO2复合大气环境中Yw值均随干/湿交替周次的增加而呈先增大后减小的趋势,表明在这些模拟环境中,随着腐蚀产物的不断生成,腐蚀产物在腐蚀初期促进钢基体的腐蚀,后期锈层对粒子扩散的阻力持续增加,即锈层致密性增强。从图8a3,b3和c3还可以看出,带锈电极在O3/SO2复合大气环境中的Yw值比在仅含SO2的大气环境中小。这说明,O3和SO2的交互作用会增加钢铁锈层的致密性。
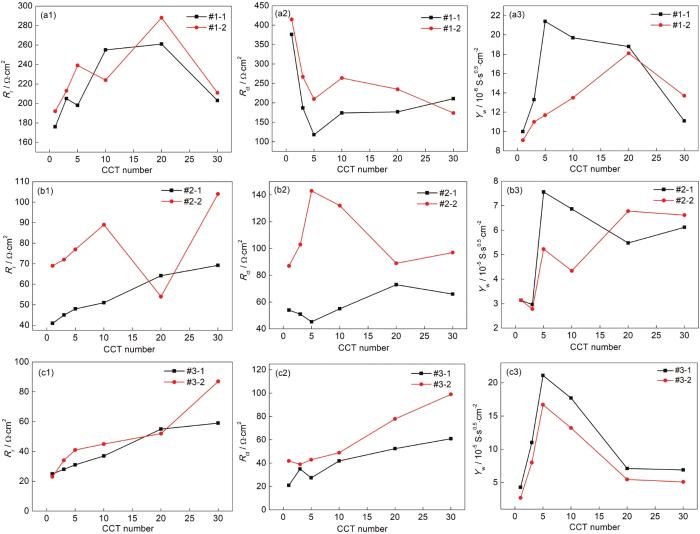
图8 Q235B钢带锈电极大气模拟液中EIS拟合结果
图9a为Q235B钢在模拟大气中经过不同腐蚀周次腐蚀后表面的3D激光显微镜照片。从图9可以看出,经过2 CCT后,所有样品均表现为腐蚀产物在中心位置的粗糙度高于四周的粗糙度,这是因为样品表面薄液膜在腐蚀初期为“半凸透镜”状,样品中心处O2浓度较低,而四周O2浓度较高,这样样品中心处与四周之间会形成氧浓差电池,样品中心处作为阳极快速溶解,造成此处腐蚀产物随着腐蚀时间的延长不断积累使得表面粗糙度增加。图9b和c可以看出,经过一段时间腐蚀后,表面腐蚀产物在四周位置也不断生成,此时整个样品表面覆盖了一层厚厚的锈层,这也与薄液膜的形状受表面腐蚀产物的影响有关。
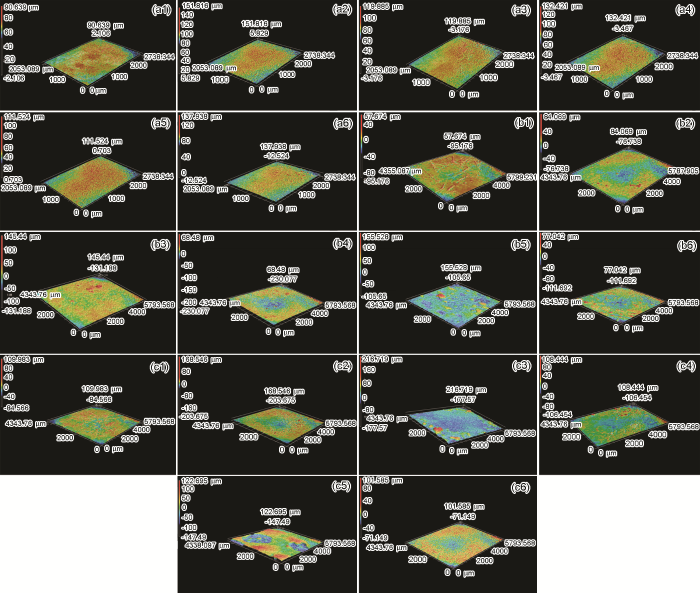
图9 Q235B钢在模拟大气中经过2 CCT,10 CCT和30 CCT腐蚀后表面的3D激光显微镜照片
此外,对比图9可见,对于同一种模拟环境中的样品,其同一位置的表面粗糙度会随腐蚀时间呈不断变化的趋势,这与样品在腐蚀过程中锈层不断发生“开裂-剥落-修复”的这个交替过程有关。
为了进一步分析表面粗糙度对低碳钢大气腐蚀速率的影响,通过3D激光显微镜测量得到了Q235B钢样品在模拟大气中经过不同时间腐蚀后的平均表面粗糙度,如图10所示。图10a显示,当模拟环境中SO2浓度为0.01 mol/L时,在仅含SO2的大气环境中,带锈电极的表面粗糙度从2 CCT至10 CCT增大,10 CCT至30 CCT基本保持不变;在O3/SO2复合大气环境中,带锈电极的表面粗糙度从2 CCT至30 CCT逐渐增大;对比两组直方图可以看出,在2 CCT时,在O3/SO2复合大气环境中带锈电极的表面粗糙度比在仅含SO2的大气环境中的大;在10 CCT时,在O3/SO2复合大气环境中带锈电极的表面粗糙度比在仅含SO2的大气环境中的小;在30 CCT时,在O3/SO2复合大气环境中带锈电极的表面粗糙度与在仅含SO2的大气环境中的相近。图10b显示,当模拟环境中SO2浓度为0.05 mol/L时,在仅含SO2的大气环境中,带锈电极的表面粗糙度从2 CCT至30 CCT逐渐增大;在O3/SO2复合大气环境中,带锈电极的表面粗糙度从2 CCT至30 CCT先增大后基本维持不变;对比两组直方图可以看出,在2 CCT时,在O3/SO2复合大气环境中带锈电极的表面粗糙度与在仅含SO2的大气环境中的相近;在10 CCT时,在O3/SO2复合大气环境中带锈电极的表面粗糙度比在仅含SO2的大气环境中的小;在30 CCT时,在O3/SO2复合大气环境中带锈电极的表面粗糙度远小于在仅含SO2的大气环境中的粗糙度。图10c显示,当模拟环境中SO2浓度为0.10 mol/L时,在仅含SO2的大气环境和在O3/SO2复合大气环境中,带锈电极的表面粗糙度从2 CCT至30 CCT均先增大后基本维持不变;对比两组直方图可以看出,在2 CCT时,在O3/SO2复合大气环境中带锈电极的表面粗糙度与在仅含SO2的大气环境中的相近;在10 CCT和30 CCT时,在O3/SO2复合大气环境中带锈电极的表面粗糙度均远小于仅含SO2的大气环境中的粗糙度。以上结果说明,带锈电极表面腐蚀产物的粗糙度随腐蚀时间和外界环境中腐蚀介质的不同而发生变化,而一般表面粗糙度越大越会促进金属的腐蚀。因而,在相同SO2浓度的模拟大气环境中,O3/SO2复合大气环境中带锈电极的表面状态相对于仅含SO2的大气环境中更有利于抑制金属的腐蚀,而且随着模拟环境中SO2浓度的升高这种抑制作用越明显,这与腐蚀速率曲线基本一致。
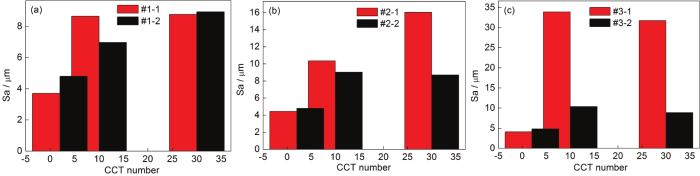
图10 Q235B钢在模拟大气中经过不同时间腐蚀后的表面粗糙度
3 分析讨论
前人研究结果表明[23-27],O3具有强的氧化性,在海岸大气环境中Cl-和O3交互作用可以促进钢铁的腐蚀,此外,O3和SO2的交互作用会促进铜的大气腐蚀,据此推测在工业大气环境中O3和SO2交互作用也可以促进钢铁的腐蚀。但通过30次干/湿交替模拟大气腐蚀实验,可见,与仅含有SO2的模拟环境对比,O3和SO2的交互作用的大气环境反而会抑制低碳钢的大气腐蚀。这与我们之前的预测结果不同。根据实验数据结果及已有的研究成果分析如下:
(1) 在腐蚀初期,阴极过程主要为O2的还原反应,腐蚀速率与O2的极限扩散电流密度成正比。在含有O3的模拟电解质溶液中溶解了大量的O3,而O3很容易分解为O2和单个原子氧:

从式 (7) 可以看出,O3在分解过程中一方面会让溶于电解质溶液中的O2含量增加,提高了O2的极限扩散电流密度,从而使得低碳钢的腐蚀速率增加;另一方面,单个原子氧具有更强的氧化性,促进还原性腐蚀产物 (如Fe3O4) 的氧化过程进行,从而有利于腐蚀产物中稳定性较强的α-FeOOH生成,从而形成保护性的锈层。
(2) 金属表面的粗糙度值的大小与金属腐蚀的程度呈正相关。通过3D激光显微镜的测量结果可以看出,O3和SO2的交互作用会降低锈层表面粗糙度,也就是促进腐蚀产物颗粒细化,这会有利于在钢基体表面形成一层致密的保护膜,阻止腐蚀性气体或液体通过表面的微观凹谷渗入到钢基体内层,从而延缓了钢铁腐蚀。
(3) 实验室加速实验模拟环境中所用的O3的浓度比一般大气环境中O3的浓度高,而不同的O3浓度可能产生不同的实验结果。因此,在接下来的研究中将考虑O3浓度对SO2大气环境中钢铁腐蚀行为的影响,探究在较低的O3浓度下,O3和SO2的交互作用将如何影响低碳钢的腐蚀。
4 结论
(1) O3和SO2的交互作用对Q235B钢的腐蚀有明显的抑制作用。
(2) 腐蚀演化特性方面,当模拟环境中Na2SO3浓度为0.01 mol/L时,O3/SO2复合大气环境中Q235B钢的腐蚀速率呈先迅速增大而后缓慢减小的趋势; 当模拟环境中Na2SO3浓度为0.05 mol/L时,O3/SO2复合大气环境中Q235B钢的腐蚀速率呈先缓慢增大后迅速下降的趋势;当模拟环境中Na2SO3浓度为0.10 mol/L时,O3/SO2复合大气环境中Q235B钢的腐蚀速率呈先增大而后缓慢减小的趋势。
(3) 与仅含有SO2的大气环境相比,当模拟大气中SO2含量较低时,O3和SO2的交互作用会促进具有保护性腐蚀产物中α-FeOOH生成;而当大气中SO2含量较高时,O3对腐蚀产物相组成影响不明显。
参考文献
1 Corvo F, Betancourt N, Mendoza A. The influence of airborne salinity on the atmospheric corrosion of steel [J]. Corros. Sci., 1995, 37: 1889
2 Dong J H, Han E-H, Ke W. Introduction to atmospheric corrosion research in China [J]. Sci. Technol. Adv. Mater., 2007, 8: 559
3 Persson D, Thierry D, Karlsson O. Corrosion and corrosion products of hot dipped galvanized steel during long term atmospheric exposure at different sites world-wide [J]. Corros. Sci., 2017, 126: 152
4 Chen W J, Hao L, Dong J H, et al. Effect of SO2 on corrosion evolution of Q235B steel in simulated coastal-industrial atmosphere [J]. Acta Metall. Sin., 2014, 50: 802
4 陈文娟, 郝龙, 董俊华等. 模拟工业-海岸大气中SO2对Q235B钢腐蚀行为的影响 [J]. 金属学报, 2014, 50: 802
5 Chen W J, Hao L, Dong J H, et al. Effect of sulphur dioxide on the corrosion of a low alloy steel in simulated coastal industrial atmosphere [J]. Corros. Sci., 2014, 83: 155
6 Henriksen J F. The distribution of NaCl on Fe during atmospheric corrosion [J]. Corros. Sci., 1969, 9: 573
7 Graedel T E, Frankenthal R P. Corrosion mechanisms for iron and low alloy steels exposed to the atmosphere [J]. J. Electrochem. Soc., 1990, 137: 2385
8 Songdao Y, translated by Jin Y K. Development and Research of Low Alloy Corrosion Resistant Steel [M]. Beijing: Metallurgical Industry Press, 2004: 235
8 松岛岩著, 靳裕康译. 低合金耐蚀钢—开发、发展及研究 [M]. 北京: 冶金工业出版社, 2004: 235
9 Ishikawa T, Miyamoto S, Kandori K, et al. Influence of anions on the formation of β-FeOOH rusts [J]. Corros. Sci., 2005, 47: 2510
10 Evans U R, Taylor C A J. Mechanism of atmospheric rusting [J]. Corros. Sci., 1972, 12: 227
11 Evans U R. Electrochemical mechanism of atmospheric rusting [J]. Nature, 1965, 206: 980
12 Leygraf C, Graedel T E. Atmospheric Corrosion [M]. New York: Wiley-Interscience, 2000
13 Allam I M, Arlow J S, Saricimen H. Initial stages of atmospheric corrosion of steel in the Arabian Gulf [J]. Corros. Sci., 1991, 32: 417
14 Asami K, Kikuchi M. In-depth distribution of rusts on a plain carbon steel and weathering steels exposed to coastal-industrial atmosphere for 17 years [J]. Corros. Sci., 2003, 45: 2671
15 Wang S T, Yang S W, Gao K W, et al. Corrosion behavior and corrosion products of a low-alloy weathering steel in Qingdao and Wanning [J]. Int. J. Min. Met. Mater., 2009, 16: 58
16 Guo M X, Pan C, Wang Z Y, et al. A study on the initial corrosion behavior of carbon steel exposed to a simulated coastal-industrial atmosphere [J]. Acta. Metall. Sin., 2018, 54: 65
16 郭明晓, 潘晨, 王振尧等. 碳钢在模拟海洋工业大气环境中初期腐蚀行为研究 [J]. 金属学报, 2018, 54: 65
17 Ge S J, Wang S J, Xu Q, et al. Ozone impact minimization through coordinated scheduling of turnaround operations from multiple olefin plants in an ozone nonattainment area [J]. Atmos. Environ., 2018, 176: 47
18 Wei W, Lv Z F, Li Y, et al. A WRF-Chem model study of the impact of VOCs emission of a huge petro-chemical industrial zone on the summertime ozone in Beijing, China [J]. Atmos. Environ., 2018, 175: 44
19 Carro-Calvo L, Ordó?ez C, García-Herrera R, et al. Spatial clustering and meteorological drivers of summer ozone in Europe [J]. Atmos. Environ., 2017, 167: 496
20 Pendlebury D, Gravel S, Moran M D, et al. Impact of chemical lateral boundary conditions in a regional air quality forecast model on surface ozone predictions during stratospheric intrusions [J]. Atmos. Environ., 2018, 174: 148
21 Jing P, Lu Z F, Steiner A L. The ozone-climate penalty in the Midwestern U.S. [J]. Atmos. Environ., 2017, 170: 130
22 Wiesinger R, Martina I, Kleber C, et al. Influence of relative humidity and ozone on atmospheric silver corrosion [J]. Corros. Sci., 2013, 77: 69
23 Screpanti A, De Marco A. Corrosion on cultural heritage buildings in Italy: a role for ozone? [J]. Environ. Pollut., 2009, 157: 1513
24 Oesch S, Faller M. Environmental effects on materials: The effect of the air pollutants SO2, NO2, NO and O3 on the corrosion of Copper, Zinc and Aluminium. A short literature survey and results of laboratory exposures [J]. Corros. Sci., 1997, 39(9): 1505
25 Chen W J, Chen Y Q, Pan G. Corrosion evolution characteristics of Q235B steel in an O3/Cl- containing atmosphere [J]. Corros. Sci. Prot. Technol., 2019, 31: 8
25 陈文娟, 陈翌庆, 潘刚. O3/Cl-复合大气环境中Q235B钢的腐蚀演化特性 [J]. 腐蚀科学与防护技术, 2019, 31: 8
26 Aastrup T, Wadsak M, Leygraf C, et al. In situ studies of the initial atmospheric corrosion of copper influence of humidity, sulfur dioxide, ozone, and nitrogen dioxide [J]. J. Electrochem. Soc., 2000, 147: 2543
27 Chen W J, Hao L, Dong J H, et al. Effect of pH value on the corrosion evolution of Q235B steel in simulated coastal-industrial atmospheres [J]. Acta Metall. Sin., 2015, 51: 191
27 陈文娟, 郝龙, 董俊华等. 模拟工业-海岸大气中pH值对Q235B钢腐蚀行为的影响 [J]. 金属学报, 2015, 51: 191
28 Kawasaki Y, Tomoda Y, Ohtsu M. AE monitoring of corrosion process in cyclic wet-dry test [J]. Constr. Build. Mater., 2010, 24: 2353
29 Thee C, Hao L, Dong J H, et al. Atmospheric corrosion monitoring of a weathering steel under an electrolyte film in cyclic wet-dry condition [J]. Corros. Sci., 2014, 78: 130
30 Stern M, Geary A L. Electrochemical polarization. I. A theoretical analysis of the shape of polarization curves [J]. J. Electrochem. Soc., 1957, 104: 56
31 Mansfeld F. 1988 Whitney Award Lecture: Don't be afraid of electrochemical techniques-but use them with care! [J]. Corrosion, 1988, 44: 856
32 Mansfeld F, Lin S, Chen Y C, et al. Minimization of high-frequency phase shifts in impedance measurements [J]. J. Electrochem. Soc., 1988, 135: 906
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





