摘要
采用牛白蛋白和右旋糖酐40模拟EPS中的蛋白质、多糖,开展了蛋白质、多糖对碳钢腐蚀速率、表面形貌、腐蚀产物、电化学行为以及浸涂前后蛋白质、多糖官能团变化研究。结果表明:碳钢浸涂蛋白质、多糖后,由于氧含量降低使腐蚀产物中具有致密性的Fe3O4含量分别上升了113.6%和145.5%,腐蚀速率分别下降了17.7%和24.0%。对EIS进行等效电路拟合后表明,未浸涂的等效电路为R(QR),浸涂蛋白质、多糖后等效电路为R(Q(R(QR)))。红外光谱实验结果显示,浸涂前后蛋白质分子中的—C=O—和—COO—,以及多糖分子中的—C—OH,—CH3,—CH2—和—COO—出现峰值减弱或消失的现象,表明碳钢浸涂蛋白质、多糖后表面形成了一层保护层,上述官能团参与了腐蚀反应且对保护层的形成起着关键作用。
关键词: 蛋白质 ; 多糖 ; 碳钢 ; 腐蚀 ; 保护层 ; 微生物胞外聚合物
微生物胞外聚合物 (EPS) 是生物垢中除了微生物和水之外最主要的组成部分,其主要来自于细胞新陈代谢过程中的分泌物、脱落的细胞表面物质、细胞自溶物以及细胞从环境中吸附的物质[1,2]。研究[3]表明,某些微生物生物膜中的EPS可以抑制金属的腐蚀。Stadler等[4]研究了脱硫弧菌的EPS对碳钢的腐蚀抑制作用,认为吸附在金属表面的脱硫弧菌的EPS能够减少细胞的吸附,抑制生物膜的生成。Dong等[5]通过研究耐热硫酸盐还原菌 (SRB) 产生的EPS对碳钢的腐蚀,证明吸附在碳钢表面的EPS层可以通过阻止氧的还原,抑制腐蚀的进行。Dong等[6]用阳离子交换树脂法从Vibrio natriegens提取EPS,碳钢试样浸涂EPS后在表面形成保护层,阻碍氧的扩散并抑制阴极氧的还原。Finkenstadt等[7]的研究结果也表明,提纯的肠膜明串珠菌的EPS能够对低碳钢表面起保护作用。Jin等[8]通过研究再生水中EPS对铸铁腐蚀的影响,使用电化学手段证明EPS使得腐蚀产物致密,阻隔溶解氧的传递,从而抑制腐蚀。Ignatova-Ivanova等[9]研究认为,Lactobacillus sp的EPS可以作为低碳钢的腐蚀抑制剂,在低碳钢表面形成保护层。Li等[10]研究海水中SRB的EPS对不锈钢腐蚀的影响,通过原子力显微镜观察显示不锈钢的表面形成了一层鱼鳞状的生物膜,可以抑制腐蚀,而且膜生长越来越致密。
EPS中含有多糖、蛋白质、脂肪酸以及无机物[11,12]等其他小分子化合物,其中蛋白质、多糖含量高达70%~80%[13,14]。Zhang等[15]研究了从海洋贻贝的EPS中提取的牛贻贝黏着蛋白对金属腐蚀的抑制作用,认为这种蛋白质在NaCl溶液中可以在碳钢表面生成一层保护层,这层高分子层对碳钢起到了保护作用。Ghafari等[16]针对从细菌的EPS中提取的多糖进行研究,认为羧基在与Fe(Ⅱ/Ⅲ) 二者结合后会在碳钢表面形成一层保护膜,进而抑制了碳钢的腐蚀。Ignatova-Ivanova等[9]的研究也得出类似结论。Zhang等[17]则通过人工合成的玉米秸秆多聚糖研究其对低碳钢的腐蚀影响,结果证明这种多聚糖能很好地抑制低碳钢在1.0 mol/L盐酸溶液中的腐蚀,而其作用机理是多聚糖中具有的N、C原子和羟基中的O原子能很好地与Fe结合吸附到低碳钢的表面,在这一过程中其吸附原理符合Langmuir等温吸附模型,同时实验证明吸附在低碳钢表面的多聚糖能很好地抑制低碳钢的阳极腐蚀。Finkenstadt等[18]也认为,提纯乳酸菌的胞外多糖通过吸附在金属表面,降低离子扩散速率,从而抑制低碳钢的腐蚀。Mobin等[19]认为,从Plantago提取的Polysaccharide在1 mol/L的HCl溶液中可以作为碳钢的绿色缓蚀剂。
目前,国内外关于EPS防腐蚀的研究刚刚起步,大部分研究是从菌种中提取的蛋白质、多糖,操作相对复杂,且并未对蛋白质、多糖抑制碳钢腐蚀的机理开展研究。因此,本实验用人工合成的牛白蛋白 (BSA)、右旋糖酐40替代从菌种中提取的蛋白质、多糖,探究蛋白质、多糖对碳钢腐蚀的抑制效果;并通过电化学实验以及对表面形貌、腐蚀产物成分分析,进一步揭示二者抑制腐蚀的机理。
1 实验方法
1.1 实验材料
1.1.1 蛋白质和多糖
蛋白质采用牛白蛋白BSA,多糖采用右旋糖酐40,均购自国药集团。牛白蛋白分子由583个氨基酸残基组成,含有少量的色氨酸、苯丙氨酸和异亮氨酸和大量的半胱氨酸、亮氨酸、谷氨酸和赖氨酸。右旋糖酐40分子量为 (2.5~5.0)×104,是一种由若干葡萄糖脱水形成的高分子聚合物,分子式为 (C6H10O5)n。
1.1.2 碳钢试片
碳钢试片尺寸为5.0 cm×2.5 cm×0.2 cm,其化学成分 (质量分数,%) 为:C 0.095,Si 0.170,Mn 0.290,P 0.012,S 0.012,Fe 99.421。实验前将碳钢试片依次浸泡在丙酮、蒸馏水、无水乙醇中清洗脱脂,然后放在干燥的滤纸上,自然风干,放入干燥器中,24 h后用分析天平称重备用。
1.2 碳钢腐蚀实验
取一定质量的蛋白质/多糖,加入超纯水,在室温下溶解并稳定2 h,制成浓度为1 mg/mL溶液[20];将处理后的碳钢试片置于溶液中浸泡24 h;自然风干6 h后用滤纸将试片包好,放入干燥器中;24 h后用分析天平称重备用。实验采用容积为6 L的AR反应器 (图1) 模拟实际管网中的水力条件。设置3组装置,分别对应未浸涂、浸涂蛋白质、浸涂多糖工况。在每个装置中放入5组挂片,每组挂片设置3个平行样。实验用腐蚀液为人工配置的腐蚀性较强的溶液,其成分为:NaCl 58.5 mg/L+Na2SO4 213 mg/L+NaHCO3 4.2 mg/L,Larson指数为2,pH值为8.3。实验溶液温度设置为30 ℃,搅拌叶片的转速为155 r/min。
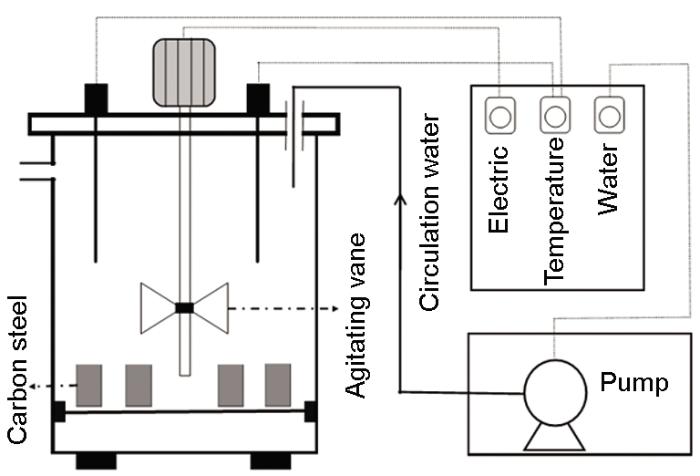
图1 实验装置示意图
分别在浸泡2,4,8,12和16 d后取出试片,冷冻干燥24 h后利用日立S4330型扫描电镜 (SEM) 观察碳钢在不同阶段的腐蚀形貌。利用QUANTAX型能谱仪 (EDS) 和帕纳科X“pert PRO型X射线衍射仪 (XRD) 分别分析腐蚀产物的化学成分及相组成。
实验结束后将挂片进行清洗,冷冻干燥24 h后用分析天平称重,计算腐蚀速率。腐蚀速率Vw(g/(m2·h)) 的计算公式[21]如下:

式中,ΔW为金属试片腐蚀前及腐蚀后重量差 (g);S为金属试片总的表面积 (m2),为28×10-4 m2;t为实验时间 (h)。
腐蚀抑制率η的计算公式如下:
![]()
式中,和分别为未浸涂和浸涂蛋白质/多糖工况时的腐蚀速率 (g/(m2·h))。
1.3 碳钢试样浸涂过程中的电化学性能测试实验
取一定质量的蛋白质、多糖,加入超纯水,在室温下溶解并稳定2 h,分别制成浓度为1 mg/mL的溶液[20]。平行设置3组烧杯,分别加入超纯水以及1 mg/mL的蛋白质和多糖溶液,对应未浸涂、浸涂蛋白质、浸涂多糖工况。在每组烧杯中,分别插入碳钢电极,在浸涂第1,3,6,9,12,18和24 h时进行电化学测试。浸涂前后,使用Nicolet 8700型红外光谱仪 (FT-IR) 分析腐蚀前后蛋白质、多糖的官能团差异。
采用CHI660C型电化学工作站开展电化学测试,测试条件为:三电极体系,参比电极为饱和甘汞电极 (SCE),辅助电极为Pt电极,工作电极为碳钢电极。电化学阻抗频率范围为105~10-2 Hz,施加正弦电位幅值5 mV;采用ZSimpWin软件分析实验数据。
碳钢电极制作方法如下:将试片切割成1 cm×1 cm的圆柱形,在非工作面焊接Cu导线,然后用环氧树脂封装。实验前用360#,600#,800#,1000#,1500#和2000#的水砂纸对碳钢电极表面逐级打磨,然后用Al2O3抛光粉抛光,之后用去离子水冲洗,丙酮除油,再用沾有乙醇的脱脂棉球擦拭电极表面,冷风吹干放入干燥器备用。
2 结果与讨论
2.1 蛋白质、多糖对碳钢腐蚀行为的影响
2.1.1 腐蚀速率
未浸涂和浸涂蛋白质/多糖后的碳钢在NaCl+Na2SO4+NaHCO3溶液中的腐蚀速率随时间的变化如图2所示。可知,浸涂了蛋白质、多糖后,碳钢的平均腐蚀速率比未浸涂的分别下降了17.7%和24.0%,即蛋白质、多糖对碳钢腐蚀的抑制率分别为17.7%和24.0%,且多糖对碳钢腐蚀的抑制效果高于蛋白质。这与Chongdar等[22]和Stadler等[23]的结论类似。Harimawan等[24]通过对B.subtilis和P.aeruginosa两菌种EPS的蛋白质、多糖研究认为,多糖与碳钢的粘附力比蛋白质更强,形成的生物膜更加致密,从而多糖抑制腐蚀的效果更好。王婧[25]的研究也表明,同质量的多糖与Fe(Ⅱ/Ⅲ) 的结合能力高于蛋白质的,EPS中多糖起到主导作用。从图2看出,碳钢第8 d的腐蚀速率较第4 d的、第16 d的腐蚀速率较第12 d的,皆有不同程度的上升,这有可能是腐蚀产物分布不均匀,加剧了碳钢点蚀,腐蚀速率升高[26,27]。
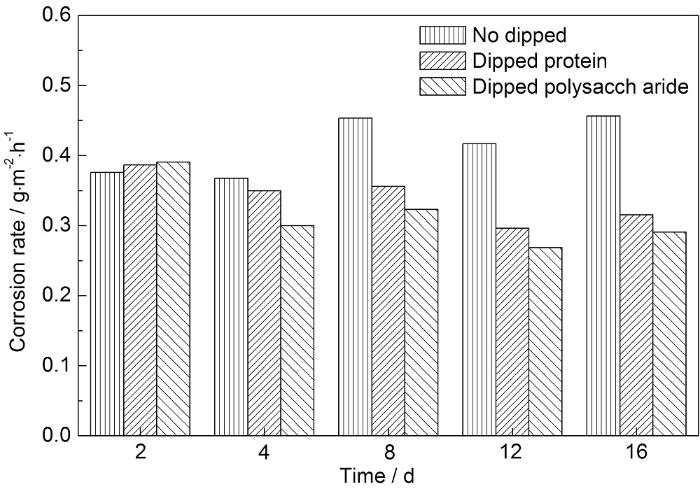
图2 未浸涂和浸涂蛋白质/多糖后的碳钢试片腐蚀速率
2.1.2 腐蚀形貌
未浸涂和浸涂蛋白质/多糖后的碳钢试片在NaCl+Na2SO4+NaHCO3溶液中浸泡16 d后的表面形貌和对应的EDS分析结果如图3所示。
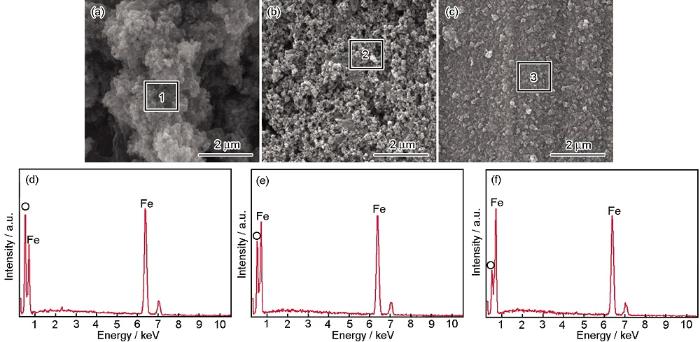
图3 未浸涂和浸涂蛋白质/多糖后的碳钢试样在浸泡16 d后表面形貌和能谱分析
未浸涂工况下,碳钢表面腐蚀产物疏松多孔 (图3a)。浸涂蛋白质 (图3b) 和多糖 (图3c) 工况下,碳钢腐蚀产物膜明显变得致密;且浸涂多糖要比浸涂蛋白质的表面孔隙明显减少,表明浸涂多糖后碳钢表面的腐蚀产物膜更加致密。Stadler等[4]和Ghafari等[16]的研究结果也证实EPS能使腐蚀产物表面形貌更为致密。
EDS分析结果显示,3种工况下试样的腐蚀产物均含有Fe和O,其中O的峰值按照从大到小的顺序依次为未浸涂工况、浸涂蛋白质工况、浸涂多糖工况,表明未浸涂工况下氧含量最多,浸涂多糖工况下氧含量最少。文献[28]表明,在氧含量较低时,腐蚀产物更加致密,这与本文的结果一致。
2.1.3 腐蚀产物
未浸涂和浸涂蛋白质/多糖后的碳钢试样浸泡第16 d的腐蚀产物XRD分析结果如图4所示。可知,3种试样的腐蚀产物主要成分均为FeOOH,Fe2O3和Fe3O4。说明蛋白质、多糖对碳钢腐蚀产物的类型未产生影响,蛋白质、多糖抑制碳钢的腐蚀并不是通过改变腐蚀产物来实现的。王婧[25]的研究也表明,罗伊氏乳杆菌EPS对碳钢表面生成的腐蚀产物种类没有影响。
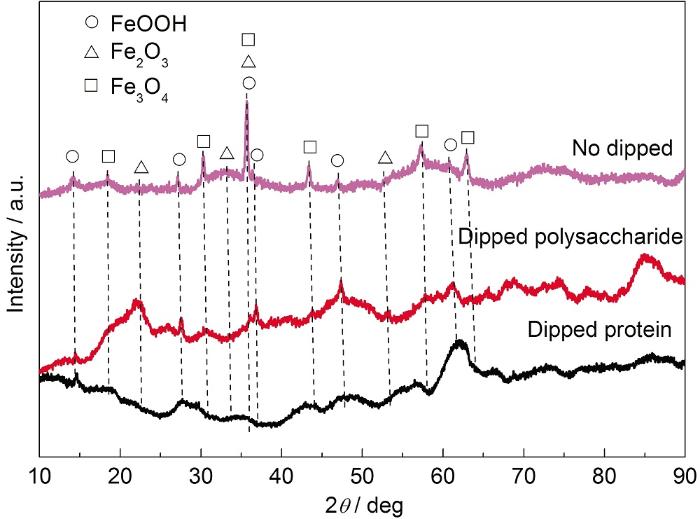
图4 未浸涂和浸涂蛋白质/多糖后的碳钢试样在浸泡16 d后的表面XRD分析结果
2.2 蛋白质、多糖抑制碳钢腐蚀的机理
2.2.1 电化学阻抗谱与等效电路
图5和6分别为碳钢电极在超纯水以及蛋白质和多糖溶液中浸涂过程中的电化学阻抗谱和Bode图,对阻抗谱进行电路拟合的等效电路如图7所示,表1为各元件拟合参数值。其中,Rs为拟合电路中的溶液电阻;Rp为极化电阻,即腐蚀电极反应中电荷转移电阻;Cf为溶液与电极之间的双电层电容,腐蚀产物层介电性能的变化可以由Cf反映出来;用Rb和Cb分别表示保护层的电阻及电容。
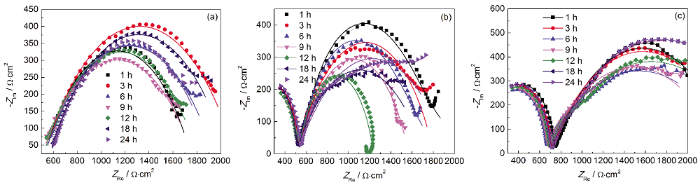
图5 碳钢电极浸泡在纯水、蛋白质溶液和多糖溶液中的Nyquist图
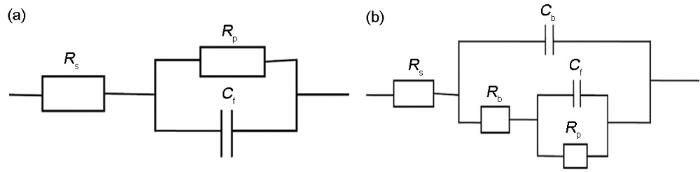
图7 电化学阻抗谱拟合的等效电路图
表1 在纯水以及蛋白质溶液和多糖溶液浸涂24 h过程中碳钢电极等效电路拟合参数
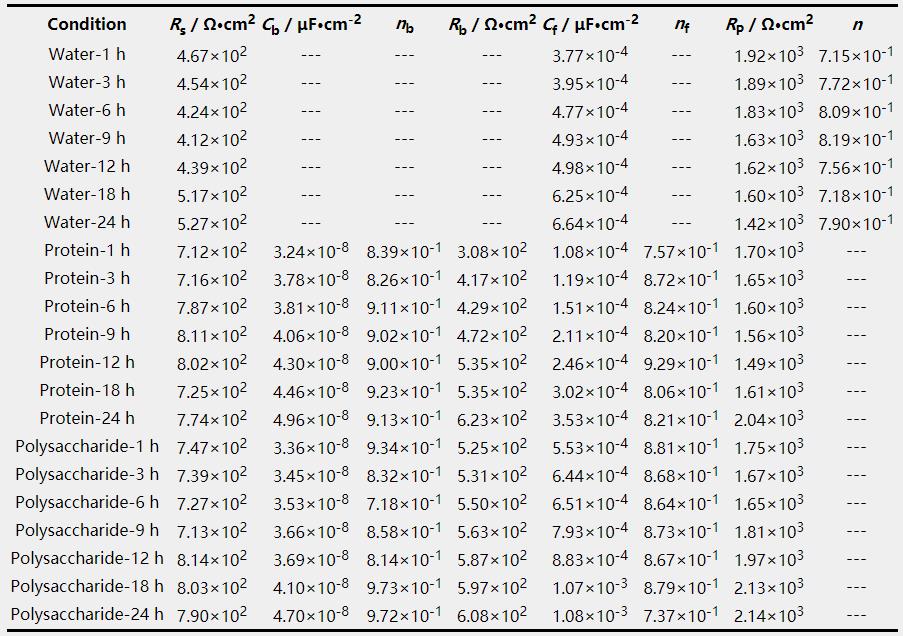
在纯水中,试样的Bode图只有一个峰,说明反应体系有一个时间常数,这与碳钢电极拟合等效电路为R(QR) 结果一致,表明未浸涂蛋白质/多糖的碳钢表面未形成保护层[29]。从表1可见,未浸涂试样的Rp值从1917 Ω·cm2降低到1415 Ω·cm2,说明碳钢在未浸涂工况下腐蚀过程中,转移电荷的阻力不断减小,腐蚀逐渐加快。
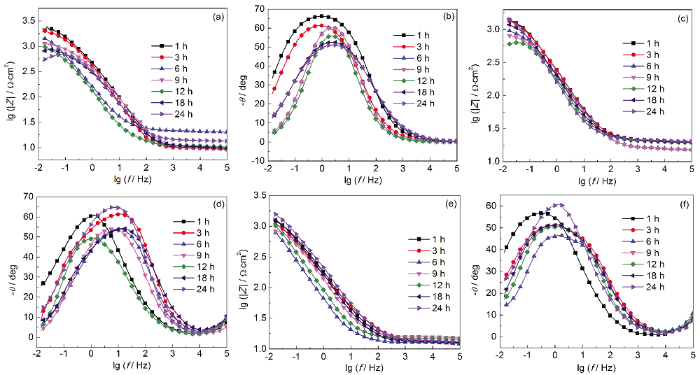
图6 碳钢电极浸泡在纯水、蛋白质溶液和多糖溶液中的Bode图
由Nyquist图可知,浸涂在蛋白质溶液和多糖溶液中试样的电化学阻抗谱由一个高频区的接近半圆的容抗弧和一个低频区接近半圆的容抗弧组成,说明反应体系有两个时间常数,Bode图中的两个峰也证实了这一点。浸涂蛋白质和多糖试样的等效电路为R(Q(R(QR))),表明浸涂了蛋白质、多糖后碳钢表面有保护层存在[29],验证了前期的推测。其中高频区容抗弧的出现与电极表面的腐蚀产物膜有关,低频区的容抗弧认为是由电荷转移过程引起的。
浸涂蛋白质工况下,碳钢电极的Rp值在第1 h为1702 Ω·cm2,第12 h降到低谷为1487 Ω·cm2,第24 h又逐渐回弹到2040 Ω·cm2。说明碳钢在浸涂蛋白质过程中转移电荷的阻力先减小后增大,即腐蚀先加快后又受到抑制。即将碳钢浸入蛋白质溶液过程中,腐蚀分为两个阶段,这与Jin等[8]和Zhang等[30]的研究结果类似。第一阶段 (第12 h之前):浸涂蛋白质工况下的Rp值小于未浸涂工况下的,在同一时间为未浸涂工况的87.26%~96.25%,表明浸涂蛋白质溶液过程中不但发生水分子与Fe(Ⅱ/Ⅲ) 的反应[29],蛋白质分子也与Fe(Ⅱ/Ⅲ) 发生反应,加剧了Fe(Ⅱ/Ⅲ) 的消耗从而加速了碳钢的腐蚀[31,32]。第二阶段 (第12 h之后):浸涂蛋白质工况的Rp值大于未浸涂工况的,此时浸涂蛋白质工况转移电荷的阻力逐渐增大,这可能是由于前期腐蚀产物的沉积使溶液中的溶解氧减少从而抑制腐蚀。
浸涂多糖工况下的等效电路拟合参数变化与浸涂蛋白质工况的趋势相同。Rp值在第1 h为1745 Ω·cm2,第6 h降到低谷为1651 Ω·cm2,第24 h又逐渐回弹到2140 Ω·cm2。浸涂多糖工况下第一阶段腐蚀持续时间为6 h,且与浸涂蛋白质工况相比,浸涂多糖工况下在同一时间Rp值是浸涂蛋白质工况下的1.01~1.33倍,这也从另一方面表明多糖对碳钢腐蚀的抑制效果好于蛋白质。
Rb反映保护层的电阻,两种浸涂工况下,Rb值分别由307.6和525.2 Ω·cm2增大到607.6和622.7 Ω·cm2,表明保护层内转移电荷的阻力不断增大。多糖工况下Rb值是蛋白质工况下的1.02~1.71倍,表明多糖比蛋白质工况下保护层的电荷转移阻力更大,这与SEM分析结果一致。
2.2.2 红外光谱
将纯蛋白质、多糖粉末与经蛋白质、多糖溶液浸泡后碳钢试样表面的腐蚀产物粉末进行红外光谱检测,结果见图8。
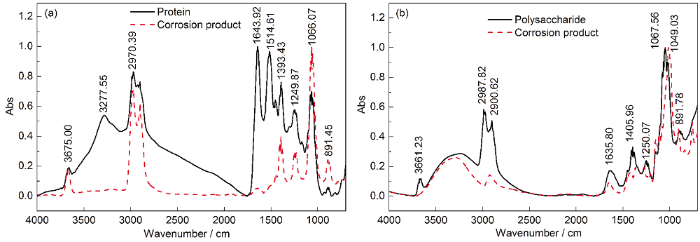
图8 纯蛋白质、多糖粉末和经蛋白质、多糖溶液浸涂24 h后碳钢试样腐蚀产物的红外光谱图
图8a中,与纯蛋白质相比,将蛋白质浸涂到碳钢表面检测可见,在1697~1641 cm-1的酰胺C=O伸缩,1543~1442 cm-1中的氨基酸COO—反对称伸缩,1411~1340 cm-1中的氨基酸COO—对称伸缩等几处峰值明显减弱或消失,表明在浸涂过程中酰胺C=O、—COO—起着主要作用,它们对蛋白质吸附在碳钢表面起着关键作用。Jin等[8]研究认为,EPS中的羧酸是导致碳钢耐腐蚀的原因。在有关聚天冬氨酸的研究中显示,Fe能与羧基螯合,并附着在金属表面阻隔侵蚀性离子的侵蚀[33]。叶小青等[34]和Liu等[2]研究认为,蛋白质中羧基、羟基等官能团含有孤对电子易与金属离子发生反应,加强EPS在碳钢表面的化学吸附作用。
图8b的红外光谱结果显示,与纯多糖相比将多糖浸涂到碳钢表面检测可见,在1119~966 cm-1基团频率区—C—OH伸缩振动发生了轻微偏移,在1411~1340 cm-1频率区的—COO—对称伸缩、2912~1831 cm-1频率区中的—CH3反对称伸缩、—CH2—对称伸缩峰值发生了明显的减弱,表明这些官能团在多糖浸涂到碳钢表面过程中起着重要的作用。Ghafari等[16]和Scheerder等[35]认为,EPS中多糖类物质的羧基基团中含有C—O、C=O键,可以与Fe(Ⅱ/Ⅲ) 等金属离子络合形成致密的保护层。红外光谱结果表明,蛋白质、多糖的某些官能团参与了腐蚀反应,对保护层的形成起了关键作用。
2.3 讨论
在碳钢表面浸涂蛋白质、多糖后,蛋白质分子中的—C=O—和—COO—,多糖分子的—C—OH,—CH3,—CH2—和—COO—会与Fe(Ⅱ/Ⅲ) 络合,络合物与腐蚀产物共同在碳钢表面形成一层保护层。XRD和SEM分析结果表明,蛋白质、多糖并未改变碳钢的腐蚀路径。碳钢初期腐蚀产物有可能起到了骨架的作用,使蛋白质、多糖络合物与腐蚀产物共同组成碳钢表面保护层,附着在碳钢表面阻止腐蚀性溶液中的腐蚀性粒子及溶解氧的侵蚀,对碳钢起到保护作用。而多糖与Fe(Ⅱ/Ⅲ) 的结合能力比蛋白质强,因此多糖工况形成的保护层更加致密,对碳钢腐蚀的抑制能力更强。
保护层的形成过程见图9a,这一阶段主要发生如下反应:第一,如图9a中 (1),在水分子以及溶解氧的作用下碳钢界面会发生腐蚀反应生成铁氧化物[30];第二,如图9a中 (2),蛋白质与多糖分子的某些官能团会与Fe(Ⅱ/Ⅲ) 发生络合反应[34],加剧了Fe(Ⅱ/Ⅲ) 的消耗,从而加速了碳钢的腐蚀。两步反应生成的铁氧化物和络合物沉积到碳钢表面,逐渐生成”络合物-腐蚀产物“复合保护层。在保护层的作用下,Fe(Ⅱ/Ⅲ) 与水分子、溶解氧、蛋白质/多糖分子的结合几率降低,电子的转移阻力逐渐增大,腐蚀受到抑制,对碳钢起很好的保护作用。Ghafari等[16]的研究结果也证实,EPS确实能使腐蚀产物更为致密。与此同时,保护层的存在很好地隔绝了溶解氧对碳钢的侵蚀,在这样一种缺氧环境中,已经生成的腐蚀产物会逐渐转化成Fe3O4 (图9b中白色虚线区域),使腐蚀产物更加致密,进一步抑制碳钢的腐蚀。但是,关于络合物与铁氧化物之间的作用,还需要作进一步的研究。
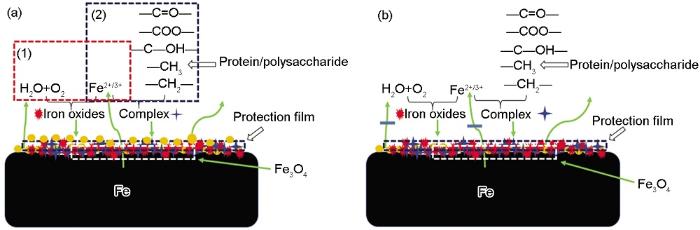
图9 ”络合物-腐蚀产物“保护层的形成机理图
3 结论
(1) 浸涂蛋白质、多糖工况下碳钢表面的腐蚀速率分别下降17.7%和24.0%,说明多糖对碳钢腐蚀的抑制效果强于蛋白质。
(2) 浸涂蛋白质、多糖后腐蚀产物仍主要为FeOOH,Fe2O3和Fe3O4,表明蛋白质、多糖抑制腐蚀不是通过改变腐蚀产物种类实现的。
(3) 在浸涂蛋白质、多糖过程中,电化学阻抗先增大后减小,表明碳钢会发生一定程度的腐蚀而后又被抑制,即保护层的形成经历两个主要阶段,第一阶段,碳钢利用蛋白质、多糖溶液中的水分子以及溶解氧在碳钢界面发生初期腐蚀;第二阶段,随着腐蚀进行,溶液中的蛋白质、多糖分子中相关官能团会与Fe(Ⅱ/Ⅲ) 结合,逐渐生成”络合物-腐蚀产物“保护层。
(4) 蛋白质分子中的—C=O—和COO—,多糖分子中—C—OH,—CH3,—CH2—和—COO—等官能团对保护层的形成起着关键作用。
参考文献
[1] Xu P. Microbiological characteristic of recycling cooling water system makeup by municipal reclaimed water in a power plant [D]. Beijing: Beijing Jiaotong University, 2013
[1] 许萍. 市政再生水补水的电厂循环冷却水系统微生物特征及控制技术研究 [D]. 北京: 北京交通大学, 2013
[2] Liu H W, Ge T Y, Asif M, et al. The corrosion behavior and mechanism of carbon steel induced by extracellular polymeric substances of iron-oxidizing bacteria [J]. Corros. Sci., 2017, 114: 102
[3] Batmanghelich F, Li L, Seo Y. Influence of multispecies biofilms of Pseudomonas aeruginosa and Desulfovibrio vulgaris on the corrosion of cast iron [J]. Corros. Sci., 2017, 121: 94
[4] Stadler R, Wei L, Fürbeth W, et al. Influence of bacterial exopolymers on cell adhesion of desulfovibrio vulgaris on high alloyed steel: Corrosion inhibition by extracellular polymeric substances (EPS) [J]. Mater. Corros., 2010, 61: 1008
[5] Dong Z H, Liu T, Liu H F. Influence of EPS isolated from thermophilic sulphate-reducing bacteria on carbon steel corrosion [J]. Biofouling, 2011, 27: 487
[6] Dong Y H, Guo N, Liu T, et al. Effect of extracellular polymeric substances isolated from Vibrio natriegens on corrosion of carbon steel in seawater [J]. Corros. Eng., Sci. Technol., 2016, 51: 455
[7] Finkenstadt V L, C?té G L, Willett J L. Corrosion protection of low-carbon steel using exopolysaccharide coatings from Leuconostoc mesenteroides [J]. Biotechnol. Lett., 2011, 33: 1093
[8] Jin J T, Wu G X, Zhang Z H, et al. Effect of extracellular polymeric substances on corrosion of cast iron in the reclaimed wastewater [J]. Bioresour. Technol., 2014, 165: 162
[9] Ignatova-Ivanova T, Ivanov R. Exopolysaccharides from lactic acid bacteria as corrosion inhibitors [J]. Acta Sci. Nat., 2016, 3: 51
[10] Li F S, An M Z, Duan D X. Corrosion inhibition of stainless steel by a sulfate-reducing bacteria biofilm in seawater [J]. Int. J. Miner., Metall. Mater., 2012, 19: 717
[11] Flemming H C, Wingender J. The Biofilm Matrix [J]. Nat. Rev. Microbiol., 2010, 8: 623
[12] Beech I B, Zinkevich V, Tapper R, et al. Study of the interaction of sulphate-reducing bacteria exopolymers with iron using X-ray photoelectron spectroscopy and time-of-flight secondary ionisation mass spectrometry [J]. J. Microbiol. Meth., 1999, 36: 3
[13] Urbain V, Block J C, Manem J. Bioflocculation in activated slud-ge: An analytic approach [J]. Water Res., 1993, 27: 829
[14] Keiding K, Nielsen P H. Desorption of organic macromolecules from activated sludge: Effect of ionic composition [J]. Water Res., 1997, 31: 1665
[15] Zhang F, Pan J S, Claesson P M. Electrochemical and AFM studies of mussel adhesive protein (Mefp-1) as corrosion inhibitor for carbon steel [J]. Electrochim. Acta, 2011, 56: 1636
[16] Ghafari M D, Bahrami A, Rasooli I, et al. Bacterial exopolymeric inhibition of carbon steel corrosion [J]. Int. Biodeterior. Biodegrad., 2013, 80: 29
[17] Zhang H X, Wang D D, Wang F, et al. Corrosion inhibition of mild steel in hydrochloric acid solution by quaternary ammonium salt derivatives of corn stalk polysaccharide (QAPS) [J]. Desalination, 2015, 372: 57
[18] Finkenstadt V L, Bucur C B, C?té G L, et al. Bacterial exopolysaccharides for corrosion resistance on low carbon steel [J]. J. Appl. Polym. Sci., 2017, 134: 45032
[19] Mobin M, Rizvi M. Polysaccharide from Plantago as a green corrosion inhibitor for carbon steel in 1 M HCl solution [J]. Carbohydr. Polym., 2017, 160: 172
[20] Xu P, Si S, Zhang Y J, et al. Effect of extracellular polymeric substances (EPS) on anti-corrosion behavior of metals [J]. Corros. Prot., 2016, 37: 384
[20] 许萍, 司帅, 张雅君等. 微生物胞外聚合物 (EPS) 对金属耐蚀性的影响 [J]. 腐蚀与防护, 2016, 37: 384
[21] Guo X M, Li C G, Chen W, et al. GB/T 18175-2014 Determination of corrosion inhibition performance of water treatment agents-rotation specimen method [S]. Beijing: China Standard Press, 2014
[21] 郭喜民, 李成国, 陈伟等. GB/T 18175-2014水处理剂缓蚀性能的测定 旋转挂片法 [S]. 北京: 中国标准出版社, 2014
[22] Chongdar S, Gunasekaran G, Kumar P. Corrosion inhibition of mild steel by aerobic biofilm [J]. Electrochim. Acta, 2005, 50: 4655
[23] Stadler R, Fuerbeth W, Harneit, et al. First evaluation of the applicability of microbial extracellular polymeric substances for corrosion protection of metal substrates [J]. Electrochim. Acta, 2008, 54: 91
[24] Harimawan A, Ting Y P. Investigation of extracellular polymeric substances (EPS) properties of P. aeruginosa and B. subtilis and their role in bacterial adhesion [J]. Colloids Surf., 2016, 146B: 459
[25] Wang J. Inhibition behavior of Lactobacillus reuteri extracellular polymeric substances on carbon steel corrosion [D]. Beijing: Beijing University of Civil Engineering and Architecture, 2015
[25] 王婧. 罗伊氏乳杆菌胞外聚合物抑制碳钢腐蚀行为研究 [D]. 北京: 北京建筑大学, 2015
[26] Liu S N, Su W, Wei Z F, et al. Corrosion behavior analysis of carbon steel in natural and sterile seawater [J]. Equip. Environ. Eng., 2013, 10(4): 16
[26] 刘世念, 苏伟, 魏增福等. 碳钢在自然海水和灭菌海水中的腐蚀行为分析 [J]. 装备环境工程, 2013, 10(4): 16
[27] Hu J Y. Study on the corrosion mechanism and anticorrosion methods of carbon steel in RO product waste of seawater [D]. Wuhan: Wuhan University, 2013
[27] 胡家元. 碳钢在海水淡化一级反渗透产水中腐蚀机理及防腐方法研究 [D]. 武汉: 武汉大学, 2013
[28] Benali O, Abdelmoula M, Refait P, et al. Effect of orthophosphate on the oxidation products of Fe(II)-Fe(III) hydroxycarbonate: The transformation of green rust to ferrihydrite [J]. Geochim. Cosmochim. Acta, 2001, 65: 1715
[29] Liu H W, Xu D K, Dao A Q, et al. Study of corrosion behavior and mechanism of carbon steel in the presence of Chlorella vulgaris [J]. Corros. Sci., 2015, 101: 84
[30] Zhang H Y, Tian Y M, Wan J M, et al. Study of biofilm influenced corrosion on cast iron pipes in reclaimed water [J]. Appl. Surf. Sci., 2015, 357: 236
[31] Beech I B, Sunner J. Biocorrosion: Towards understanding interactions between biofilms and metals [J]. Curr. Opin. Biotechnol., 2004, 15: 181
[32] Moradi M, Song Z L, Tao X. Introducing a novel bacterium, Vibrio neocaledonicus sp., with the highest corrosion inhibition efficiency [J]. Electrochem. Commun., 2015, 51: 64
[33] Huo Y N, Liu S, Lu Z. Research on synthesis and behavior of Polyaspartic acid—A new type polymeric scale inhibitors [J]. Fine Chem., 2000, 17: 581
[33] 霍宇凝, 刘珊, 陆柱. 新型聚合物阻垢剂聚天冬氨酸的合成与性能 [J]. 精细化工, 2000, 17: 581
[34] Ye X Q, Peng T Y, Ji Y X, et al. Application progress of microorganism extracellular polymeric substances in environmental engineering [J]. J. Hangzhou Norm. Univ. (Nat. Sci. Ed.), 2016, 15: 387
[34] 叶小青, 彭亭瑜, 姬玉欣等. 微生物胞外聚合物在环境工程中的应用进展 [J]. 杭州师范大学学报 (自然科学版), 2016, 15: 387
[35] Scheerder J, Breur R, Slaghek T, et al. Exopolysaccharides (EPS) as anti-corrosive additives for coatings [J]. Prog. Org. Coat., 2012, 75: 224
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





