摘要
采用腐蚀挂片和动电位极化曲线测量两种实验方法并结合微观腐蚀形貌观察,验证了NaNO3的存在对304L不锈钢在HNO3_NaNO3水溶液环境下腐蚀行为的影响,并在此基础上探讨了NaNO3浓度和溶液温度对腐蚀的影响。结果表明,304L不锈钢在NaNO3水溶液环境下腐蚀极轻微,未检测到失重;但是在HNO3-NaNO3水溶液环境下,NaNO3的存在诱发或加剧了304L不锈钢的晶间腐蚀。304L不锈钢在水溶液和蒸汽中的腐蚀均随NaNO3浓度的增大或温度的升高而加剧,材料在蒸汽中优先发生晶间腐蚀,甚至出现晶粒脱落;温度升高可增强NaNO3对腐蚀的促进作用。
关键词: 奥氏体不锈钢 ; 硝酸 ; 硝酸盐 ; 晶间腐蚀
奥氏体不锈钢是废核燃料后处理、硝酸生产等化工设备的主要结构材料,其在机械强度、耐蚀性、加工性和成本效率等方面具有极好的综合表现,表面的钝态富铬氧化物膜使其免受剧烈腐蚀。硝酸是一种强氧化性酸,有助于不锈钢的钝化。然而,奥氏体不锈钢易于发生局部腐蚀,硝酸浓度、温度、溶液中离子浓度的升高均会促使不锈钢由钝化态转变为过钝化态,从而发生晶间腐蚀[1,2,3,4]。因此,对于特定的不锈钢,应确切限定这些参数范围以避免发生严重的晶间腐蚀。
影响304L不锈钢在硝酸环境下腐蚀的因素很多,并且已得到了广泛研究,主要分为两方面,一是材料因素,如杂质元素、金相组织等;二是环境因素,如浓度、温度、氧化性金属离子和其它杂质离子等。其中,环境因素中关于离子成分的影响,大量报道是关于与废核燃料后处理和硝酸生产相关的F-和Cl-的[5,6],还有部分关于Cr6+和V5+等氧化性金属离子的[7,8],而目前关于硝酸盐对硝酸腐蚀影响的研究只有少量关于电化学性能的报道[8]。本文根据某存在HNO3-NaNO3腐蚀环境的工业生产设备的腐蚀调研情况,通过模拟现场工况研究了该设备结构用材304L不锈钢在HNO3-NaNO3水溶液环境下的腐蚀行为,探讨了NaNO3浓度和温度的影响作用,为304L不锈钢在HNO3-NaNO3环境下的腐蚀控制提供参考。
1 实验方法
1.1 腐蚀挂片实验
实验材料为商业纯度的304L奥氏体不锈钢,其化学成分 (质量分数,%) 为:C 0.019,Si 0.41,Mn 1.26,P 0.035,S 0.003,Cr 18.31,Ni 8.02,Fe 余量。试样规格为40 mm×13 mm×2 mm,表面依次用600和800#砂纸打磨,用丙酮除油、无水乙醇脱水吹干,最后称重。
实验装置为1000 mL聚四氟乙烯釜。试样安装在聚四氟乙烯绝缘支架上,置于釜内,注入550 mL腐蚀介质 (溶液体积与试样表面积的比值均为23 mL·cm-2),保证处于水溶液和蒸汽中的试样各两片。将密封的釜体置于油浴中加热至实验温度并保温,实验周期为96 h,此期间未对溶液进行更新。实验结束后,在60 ℃下用10% (体积分数) 硝酸洗液清除试样表面的腐蚀产物或附着物。根据失重计算平均腐蚀速率,并利用S-3400型扫描电镜 (SEM) 和Axiovert 40MAT型金相显微镜分析试样的表面微观腐蚀形貌和晶间腐蚀深度。
1.2 电化学实验
采用Zennium Pro电化学工作站,三电极体系进行动电位扫描,工作电极为304L不锈钢,辅助电极是316不锈钢,参比电极是Ag-AgCl (SSC)。极化曲线扫描速率为0.167 mV/s,扫描范围为-0.2~1 V (相对于开路电位)。实验温度为30 ℃。
2 实验结果
2.1 304L不锈钢在NaNO3,HNO3和HNO3-NaNO3水溶液环境下的腐蚀
为考察NaNO3对304L不锈钢在HNO3溶液中腐蚀的影响,在对304L不锈钢在23% (质量分数) NaNO3、2%HNO3及4%HNO3水溶液环境下腐蚀评价的基础上,分别向2%HNO3和4%HNO3水溶液中加入23%NaNO3做相同实验进行对比,腐蚀速率见表1。304L不锈钢在NaNO3水溶液环境下未检测出失重,腐蚀极轻微;在HNO3水溶液中加入23%NaNO3后,304L不锈钢在水溶液中的腐蚀速率明显增大,蒸汽中的腐蚀速率也有所增大,且水溶液中的腐蚀速率明显高于蒸汽中的腐蚀速率;HNO3浓度较高时 (4%),腐蚀速率相对较大。从上述结果可看出,NaNO3水溶液本身对304L不锈钢的腐蚀极轻微,但当其与HNO3共存时,能显著促进304L不锈钢的腐蚀,尤其是在水溶液中。
表1 304L不锈钢在NaNO3、HNO3及HNO3-NaNO3的水溶液和蒸汽中的腐蚀速率
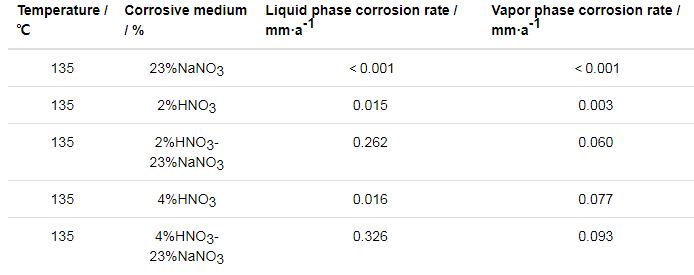
图1为304L不锈钢在NaNO3水溶液和蒸汽中腐蚀后的SEM像。可看出,试样表面均匀,打磨条纹清晰可见,无明显腐蚀痕迹,进一步印证了NaNO3水溶液对304L不锈钢几乎无腐蚀性。图2为304L不锈钢在HNO3、HNO3-NaNO3的水溶液和蒸汽中腐蚀后的SEM像。304L不锈钢在2%HNO3水溶液和蒸汽中均腐蚀轻微,为均匀腐蚀;加入23%NaNO3之后,水溶液中的试样表面有明显的晶间腐蚀沟槽产生,而蒸汽中的试样表面局部区域出现表皮剥落,裸露部分也可观察到明显的晶间腐蚀。304L不锈钢在4%HNO3水溶液中仍为均匀腐蚀,而在蒸汽中已发生局部腐蚀,部分区域出现细微的晶间腐蚀沟槽;加入23%NaNO3之后,水溶液中的试样表面呈明显的晶间腐蚀特征,蒸汽中的试样表面局部发生严重的晶间腐蚀,甚至已发展到晶粒脱落。图3a和b分别为304L不锈钢在135 ℃、4%HNO3-23%NaNO3水溶液和蒸汽中腐蚀后的截面形貌。可看出,水溶液中试样的晶间腐蚀深度小于晶粒尺寸,有沿不同晶界方向的腐蚀沟槽;而蒸汽中试样腐蚀较严重区域的晶间腐蚀深度已超过晶粒尺寸,表面晶粒间有分离倾向,部分晶粒已脱落。测得水溶液和蒸汽中试样的晶间腐蚀最大深度分别为14.76和30.88 μm。上述结果表明,在HNO3-NaNO3水溶液中,NaNO3的存在明显促进了304L不锈钢的腐蚀,诱发或加剧晶间腐蚀。

图1 304L不锈钢在135 ℃,23%NaNO3的水溶液和蒸汽中腐蚀后的SEM像

图2 304L不锈钢在HNO3,HNO3-NaNO3的水溶液和蒸汽中腐蚀后的SEM像

图3 304L不锈钢在135 ℃,4% HNO3-23%NaNO3的水溶液和蒸汽中腐蚀后的截面形貌
为直观、快捷地考察NaNO3对304L不锈钢电化学腐蚀行为的影响,开展了相应的电化学实验。图4为30 ℃ 时,304L不锈钢在2%HNO3和2%HNO3-23%NaNO3水溶液中的动电位极化曲线。与HNO3水溶液相比,304L不锈钢在HNO3-NaNO3水溶液中的自腐蚀电位升高,说明NaNO3的存在增强了溶液的氧化性,有利于不锈钢的钝化,但是钝化区明显变小,腐蚀电流密度也有所增大。总体来说,NaNO3的存在增强了304L不锈钢的过钝化腐蚀敏感性,加速了304L不锈钢表面钝化膜的溶解,促进其由钝化态向过钝化态转变,使腐蚀加剧。
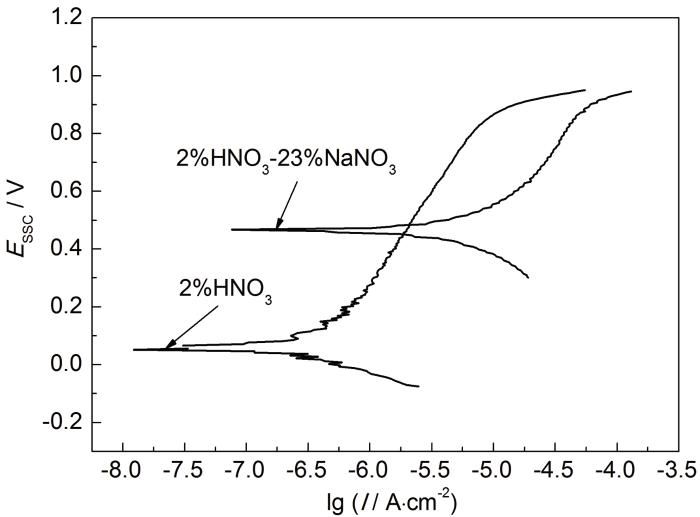
图4 304L不锈钢在HNO3和HNO3-NaNO3水溶液中的极化曲线
2.2 NaNO3浓度对腐蚀的影响
在2%HNO3和4%HNO3水溶液的基础上,考察了NaNO3浓度对304L不锈钢腐蚀的影响,腐蚀速率见表2。与HNO3水溶液相比,分别加入10%和15% NaNO3后,试样在水溶液和蒸汽中的腐蚀速率均有所增大,且蒸汽中的腐蚀速率高于水溶液中的腐蚀速率;当NaNO3浓度增大到23%时,水溶液中的腐蚀速率大幅增大,此时水溶液中的腐蚀速率明显高于蒸汽中的腐蚀速率。
表2 304L不锈钢在135 ℃下不同NaNO3浓度的HNO3-NaNO3水溶液和蒸汽中的腐蚀速率
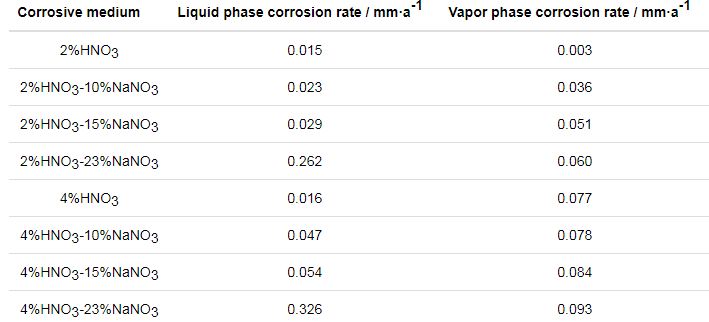
图5和6为304L不锈钢在不同NaNO3浓度的HNO3-NaNO3水溶液和蒸汽中腐蚀后的SEM像。当NaNO3浓度不高于15%时,304L不锈钢在水溶液中为均匀腐蚀;当NaNO3浓度增大到23%时 (见图2),304L不锈钢在水溶液中发生明显晶间腐蚀。可见,NaNO3浓度的增大促进了304L不锈钢由钝化态向过钝化态转变。对于HNO3浓度为2%的HNO3-NaNO3水溶液,NaNO3含量为15%时,304L不锈钢在蒸汽中优先发生晶间腐蚀;而对于HNO3浓度为4%的HNO3-NaNO3水溶液,NaNO3浓度为10%时,304L不锈钢在蒸汽中就已发生晶间腐蚀。可见,HNO3浓度越高,304L不锈钢在蒸汽中越易发生晶间腐蚀;在同一HNO3浓度下,在蒸汽中的晶间腐蚀程度随NaNO3浓度的增大而加重。

图5 304L不锈钢在2%HNO3-(10%,15%) NaNO3水溶液和蒸汽中腐蚀后的SEM像

图6 304L不锈钢在4%HNO3-(10%,15%) NaNO3水溶液和蒸汽中腐蚀后的SEM像
综上所述,304L不锈钢在水溶液和蒸汽中的腐蚀速率均随NaNO3浓度的增大而增大,其中水溶液中的腐蚀速率先是缓慢增大而后急剧增大,并超过蒸汽中的腐蚀速率;汽相试样表面不均匀,局部区域优先发生晶间腐蚀;当NaNO3浓度增大到一定值时,试样在水溶液中由均匀腐蚀变为晶间腐蚀,而在蒸汽中的晶间腐蚀也明显加剧,出现晶粒脱落。值得注意的是,在4%HNO3-23%NaNO3水溶液环境下,虽然试样在水溶液中的失重远高于蒸汽中的,但蒸汽中试样局部区域发生的晶间腐蚀明显较水溶液中的严重,这是由水溶液和蒸汽中的腐蚀机制不同所致。
2.3 温度对腐蚀的影响
表3为304L不锈钢在120和135 ℃的HNO3-NaNO3水溶液和蒸汽中的腐蚀速率。当温度为120 ℃时,试样在水溶液和蒸汽中的腐蚀速率均较小,且蒸汽中的腐蚀速率高于水溶液中的;当温度升高到135 ℃时,水溶液中的腐蚀速率增大了两个数量级,蒸汽中的腐蚀速率也有所增大,此时水溶液中的腐蚀速率高于蒸汽中的腐蚀速率。结合表2中的数据,可见温度对304L不锈钢在HNO3-NaNO3水溶液环境下的腐蚀影响较大。在120 ℃时,304L不锈钢在HNO3、NaNO3浓度为23%的HNO3-NaNO3水溶液和蒸汽中的腐蚀速率明显低于其在135 ℃的HNO3水溶液环境下的腐蚀速率;但当温度升至135 ℃时,304L不锈钢在HNO3-NaNO3水溶液环境下的腐蚀速率明显高于其在HNO3环境下的腐蚀速率,可见温度升高明显增强了NaNO3对腐蚀的促进作用。
表3 304L不锈钢在不同温度的HNO3-NaNO3水溶液和蒸汽中的腐蚀速率
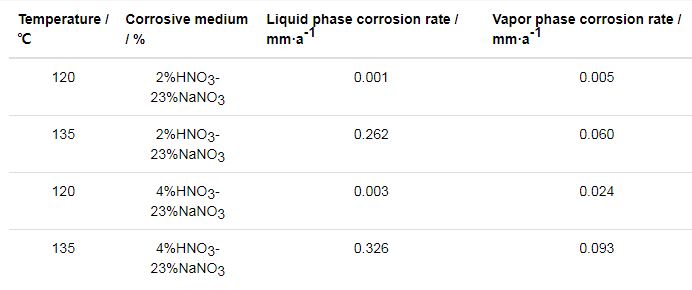
图7和8为304L不锈钢在120和135 ℃的HNO3-NaNO3水溶液和蒸汽中腐蚀后的SEM像。在120 ℃时,304L不锈钢在两种HNO3浓度的HNO3-NaNO3水溶液中均为均匀腐蚀;当温度升高到135 ℃时,304L不锈钢在水溶液中由均匀腐蚀变为晶间腐蚀。温度升高也明显加快了蒸汽中晶间腐蚀的发生和发展。

图7 304L不锈钢在不同温度的2%HNO3-23%NaNO3水溶液和蒸汽中腐蚀后的SEM像

图8 304L不锈钢在不同温度的4%HNO3-23%NaNO3水溶液和蒸汽中腐蚀后的SEM像
综合以上数据,温度对304L不锈钢在HNO3-NaNO3水溶液环境下的腐蚀影响较大,温度升高可增强NaNO3对腐蚀的促进作用,诱发水溶液中的试样发生晶间腐蚀,并加快蒸汽中试样晶间腐蚀的发生和发展。
3 分析与讨论
HNO3-NaNO3水溶液和其蒸汽的腐蚀作用机制存在不同,以下分开进行讨论。
腐蚀挂片和电化学实验结果均证实,NaNO3的存在增强了304L不锈钢的晶间腐蚀敏感性,促进其由均匀腐蚀向晶间腐蚀转变。在大多数的HNO3介质中,决定溶液氧化还原电位的电化学反应是HNO3被还原成HNO2的总反应[9,10,11]:
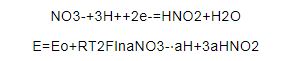
式中,E为溶液的氧化还原电位 (V);Eo为溶液的标准氧化还原电位 (V);R为摩尔气体常数 (8.314 J/(mol·K));T为热力学温度 (K);F为Faraday常数 (96485.33289 C/mol);aNO3-,aH+和aHNO2分别为溶液中NO3-,H+和HNO2的活度。
从式 (2) 可知,氧化还原电位随NO3-和H+浓度的增大、温度的升高而升高,随亚硝酸浓度的升高而降低。向HNO3水溶液中加入NaNO3后,溶液中的NO3-浓度增大,溶液的氧化还原电位升高,氧化性增强。对于135 ℃的HNO3-NaNO3水溶液 (HNO3浓度为2%~4%),NaNO3浓度在15%~23%内存在一个临界值。NaNO3浓度低于该值时,溶液氧化性增强,在一定程度上加快了304L不锈钢的活性溶解,304L不锈钢在水溶液中的腐蚀速率随NaNO3浓度的升高缓慢增大,但材料总体仍处于钝化态,呈均匀腐蚀;当NaNO3浓度高于该值时,溶液的氧化性增大,致使材料由钝化态转变为过钝化态,表面含铬钝化膜被溶解,材料发生晶间腐蚀,腐蚀速率大幅增大。另外,腐蚀挂片的结果还表明,温度升高明显增强了NaNO3对腐蚀的促进作用,这是因为在较高温度下,溶液的氧化还原电位相对较高;加入NaNO3后,溶液的氧化还原电位升高较快,使材料更易转变为过钝化态而发生晶间腐蚀。因此,温度越高,NaNO3含量应控制得越低。在135 ℃、2%~4%的HNO3溶液中,建议NaNO3含量控制在15%以下。
在HNO3-NaNO3水溶液环境下,304L不锈钢在蒸汽中优先发生晶间腐蚀。从腐蚀失重来看,在NaNO3浓度为23%的HNO3-NaNO3水溶液环境下,试样在水溶液中的腐蚀速率高于其在蒸汽中的,但蒸汽中局部的晶间腐蚀程度仍高于水溶液中的。根据HNO3腐蚀机理的相关研究[2,12,13],HNO3通过自催化过程被间接还原生成的HNO2才是电活性物种,亚硝酸被还原生成的NO又继续与HNO3反应生成亚硝酸,使亚硝酸得以再生,即NO催化了HNO3的还原;另一方面不锈钢自身腐蚀溶解生成的Cr6+和Fe3+等氧化性金属离子可以氧化金属元素,而被还原的金属阳离子再次被HNO3氧化,从而催化了HNO3的还原,加速了金属的腐蚀溶解,即不锈钢的自催化腐蚀[14]。有研究[15]表明,控制腐蚀的一个重要参数是液体体积与金属面积的比值V/S。从腐蚀开始到发生晶间腐蚀所需时间取决于此值,此比值越小,材料发生晶间腐蚀越快。蒸汽中试样表面的液膜或冷凝液的体积远小于溶液本体体积,使得试样表面的液膜或冷凝液中的HNO3还原产物和金属氧化产物不易扩散,浓度相对较高。根据上述HNO3和不锈钢的自催化腐蚀机理,HNO3的还原产物 (HNO2和NO) 和不锈钢自身腐蚀形成的金属氧化性离子 (Fe3+和Cr6+) 可催化HNO3还原反应,这种自催化现象使不锈钢的腐蚀电位向过钝化区迁移,故导致蒸汽中的试样优先发生晶间腐蚀,腐蚀程度也更为严重。
304L不锈钢在蒸汽中的腐蚀随NaNO3浓度的增大而加剧。NaNO3对蒸汽的作用机制与水溶液不同,其对蒸汽中腐蚀的影响是间接的,可能有两方面的原因,一是根据溶液的依数性,NaNO3的加入使溶液的沸点升高,蒸气压降低,即蒸汽中的水蒸气含量变少,试样表面的冷凝液循环更新变慢,因此NaNO3浓度越高,HNO3还原产物和金属氧化产物在液膜或冷凝液中越易聚集,越易催化HNO3还原,加速金属进入过钝化态,发生晶间腐蚀;二是NaNO3的存在使得溶液本体的NO3-浓度增大,HNO3更易向蒸汽中挥发,一定程度上提高了液膜或冷凝液中HNO3的平衡浓度,从而使材料在蒸汽中的腐蚀加剧。
4 结论
(1) 304L不锈钢在NaNO3水溶液环境下腐蚀极轻微,未检测到失重;但是在HNO3-NaNO3水溶液环境下,NaNO3的存在诱发或加剧了304L不锈钢的晶间腐蚀。
(2) 304L不锈钢在水溶液和蒸汽中的腐蚀均随NaNO3浓度的增大或温度的升高而加剧,材料在蒸汽中优先发生晶间腐蚀,甚至出现晶粒脱落。
(3) 温度升高可增强NaNO3对腐蚀的促进作用。在条件允许情况下,尽量通过降低温度来控制304L不锈钢在HNO3-NaNO3水溶液环境下的腐蚀;在135 ℃、2%~4% (质量分数) 的HNO3溶液中,建议NaNO3含量控制在15%以下。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





