川大何斌/成大高文霞/温医大附一院叶雪挺AM:多功能新型可融合微球FRMs——从长效显影到高效栓塞
2024-08-15 17:22:40
作者:高分子科学前沿 来源:高分子科学前沿
分享至:
经导管动脉栓塞(TAE)是一种微创治疗方法,通过阻断特定血管的血流来治疗疾病。医生使用导管将栓塞材料注入目标血管,阻断血流,从而减少或切断病变区域的血液供应。这种技术广泛应用于肿瘤、出血性疾病和动静脉畸形的治疗。根据治疗的不同需求和血管的大小,使用的栓塞材料也有所不同。小血管通常使用细小颗粒或液体栓塞剂,而大血管可能需要使用线圈或较大的颗粒。短期出血控制常用可吸收的明胶海绵,而肿瘤治疗则需要长期有效的微球或放射性微球。微球可以在治疗过程中精确调节大小,但面临两个问题:模量太低时,微球易在血压下破碎,导致意外栓塞;模量太高时,微球难被压缩,无法完全阻断血流。凝胶类栓塞剂虽然能完全阻塞血管,但其成胶的时间和位置难以精确控制。
针对上述问题,四川大学何斌教授、成都大学高文霞教授和和温州医科大学附属第一医院叶雪挺副主任医师等团队合作设计了一种两亲性聚氨酯PCEU,以负压诱导快速溶剂挥发法,制备了一种新型的负载碘油为显影剂的微球(FRMs)用于栓塞治疗。FRMs在血管中能够融合成一个整体,既具备微球的优势,可以根据目标血管的大小进行精确调控和递送,又具备凝胶的优点,能够完全阻塞血管,从而提供稳定、持久的栓塞效果(如图1所示)。FRMs在X光下显影,能够更好的帮助医生精确将微球植入目标血管中,还方便持续监测治疗效果。相关论文以“Fusible and Radiopaque Microspheres for Embolization”为题,近日发表在《Advanced Materials》上。本文第一作者为四川大学李静博士,通讯作者为何斌教授、高文霞教授,叶雪挺副主任医师,该工作得到了国家自然科学基金委的支持。
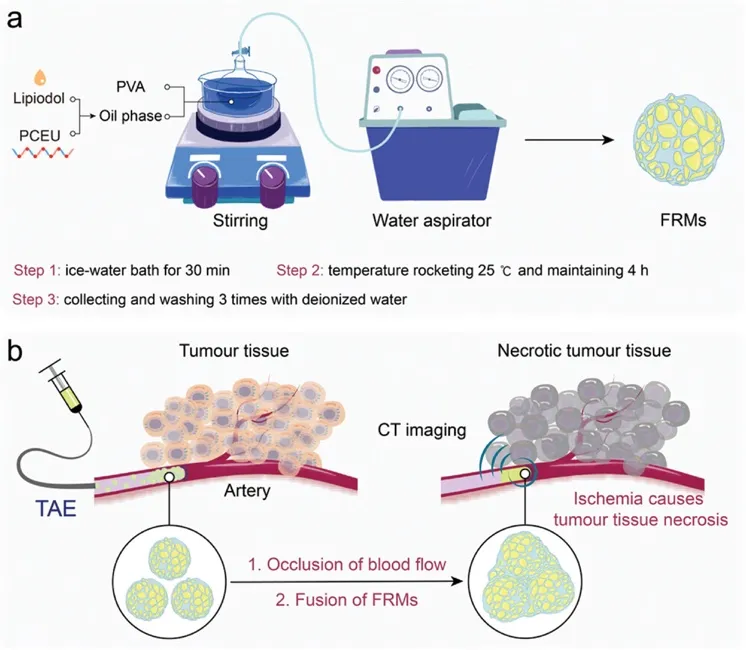
图1 FRMs微球的制备和栓塞示意图:a) FRMs的制备过程。b) 在X射线血管造影引导下进行的FRMs栓塞过程
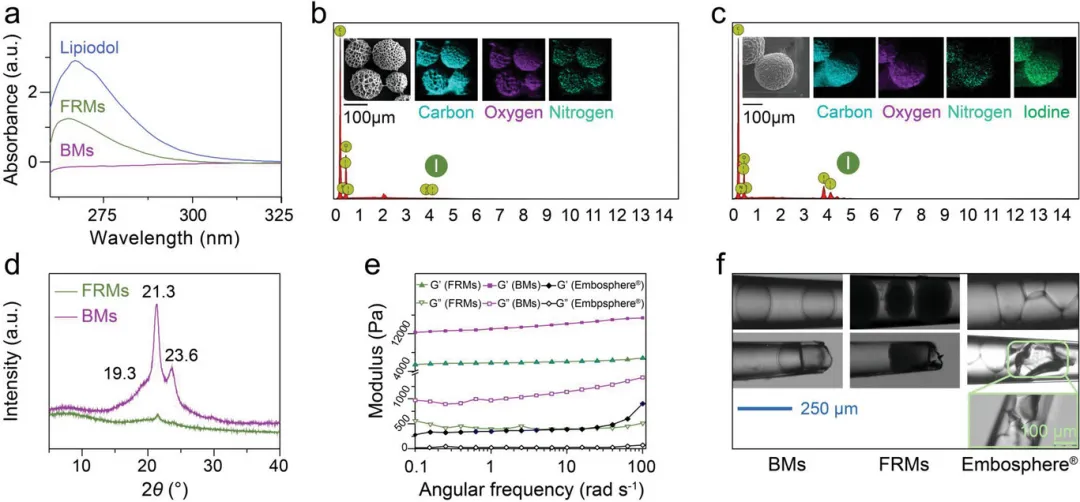
图2 FRMs中碘油的包封及FRMs的可注射性:a) 碘油、FRMs和BMs的紫外-可见吸收光谱 b) BMs的元素分布图,c) FRMs的元素分布图 d) FRMs和BMs的XRD(X射线衍射)图谱 e) BMs、FRMs和EmbosphereⓇ微球的压缩测试 f) 栓塞微球在37°C下血管内运输的模拟

图3 FRMs的稳定性:a) FRMs在体外的显影性评估,BMs和FRMs的CT图像灰度值在图中以黑色直线表示(不同稀释度的商业对比剂(LoversolⓇ)的CT图像灰度值作为参考(紫色柱状图)) b) BMs和FRMs在0.01 M PBS(pH 7.4,37°C)中放置1周和4周后的光学图像 c) BMs和FRMs在0.01 M PBS(pH 7.4,37°C)中放置4周后的1H NMR图谱,以及PCEU的1H NMR图谱 d) FRMs的显影稳定性(在0.01 M PBS(pH 7.4,37°C)中不同时间点的FRMs的体外CT图像及其灰度值) e) FRMs在肝脏区域0周时的CT图像 f) 1周后的CT图像通过紫外分光光度计(UV-Vis)和能谱分析(EDS)确认了碘油成功负载到微球中,EDS发现碘元素分布在微球表面,表明碘油不仅存在微球内部,还渗透在聚合物基质中。X射线衍射(XRD)显示FRMs的衍射峰强度显著降低,表明碘油在微球中起到了增塑剂的作用,增强了高分子链段的运动,降低了微球中高分子链段的结晶度,使FRMs比BMs具有更低的模量(见图4),更易发生形变。FRMs可以通过压缩顺利通过直径比其自身更小的微导管和血管。以临床中广泛应用的显影剂碘水LoversolⓇ作为对照,发现FRMs在X光下显影清晰。FRMs在磷酸盐缓冲液(PBS)中于37.5 ℃孵育28天,仍可保持微球的形貌和显影能力,说明FRMs具有长效显影功能。FRMs植入大鼠肝脏一周后用Macro-CT观察,仍能在肝脏血管中清晰显影,进一步确认了FRMs在体内具有长效显影的能力。图4 FRMs的体内生物安全性及融合性:a) BMs和FRMs植入皮下后不同时间点的皮肤组织以及未处理的对照组的皮肤组织的H&E染色结果 b) FRMs(绿色)和BMs(蓝色)的DSC二次加热曲线 c) BMs和FRMs在不同温度下放置2小时的光学图像 d) FRMs在37.5°C下放置4小时的光学图像图5 FRMs的体内栓塞:a) 不同时间点(1、3、5、7和10天)内对兔子右耳进行EmbosphereⓇ、BMs或FRMs栓塞,以及左耳用生理盐水处理后的结果 b) 栓塞后14天兔子耳朵的H&E染色图像生物安全性的评价对于生物材料的临床应用至关重要,将FRMs植入大鼠的背部皮下进行生物相容性评价。初期FRMs引起微弱的炎症反应,随着时间的推移,炎症反应逐渐消退,显示出良好的生物相容性。有趣的是,我们发现FRMs微球在皮下会融合成一个整体,而不像在PBS中那样保持分散。为了探索这一现象的机制,我们通过差示扫描量热仪(DSC)进行分析,结果表明FRMs的熔融峰显著变小,熔融温度降低至33.2 ℃,因此,当环境温度高于33.2 ℃时,微球便会相互融合。而在PBS环境中,FRMs始终保持分散状态,可能是由于水分子在微球表面形成了一层水膜,阻止了它们的融合。而在皮下环境中,微球紧密接触,没有水膜阻隔,自然融合成一个整体,使FRMs在体温下产生自融合效应。最后,进行了一个关键的栓塞模拟实验:兔耳栓塞模型。结果显示,FRMs在血管内融合得非常好,这是由于血液的压力挤出了微球间的水分子,使微球之间接触更加紧密,产生自融合。这一特性使得FRMs的栓塞效果显著优于临床使用的微球(EmbosphereⓇ)和空白微球(BMs),有望成为一种高效栓塞剂应用于临床。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。











