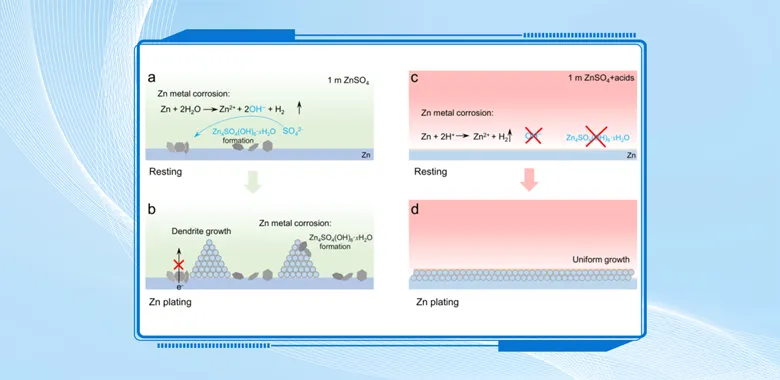
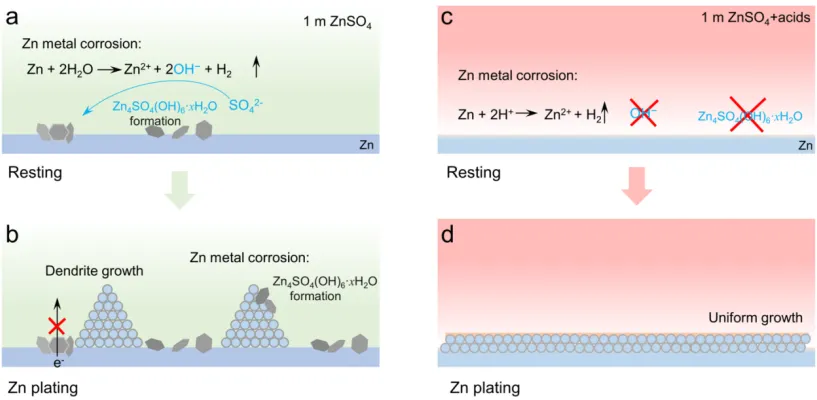
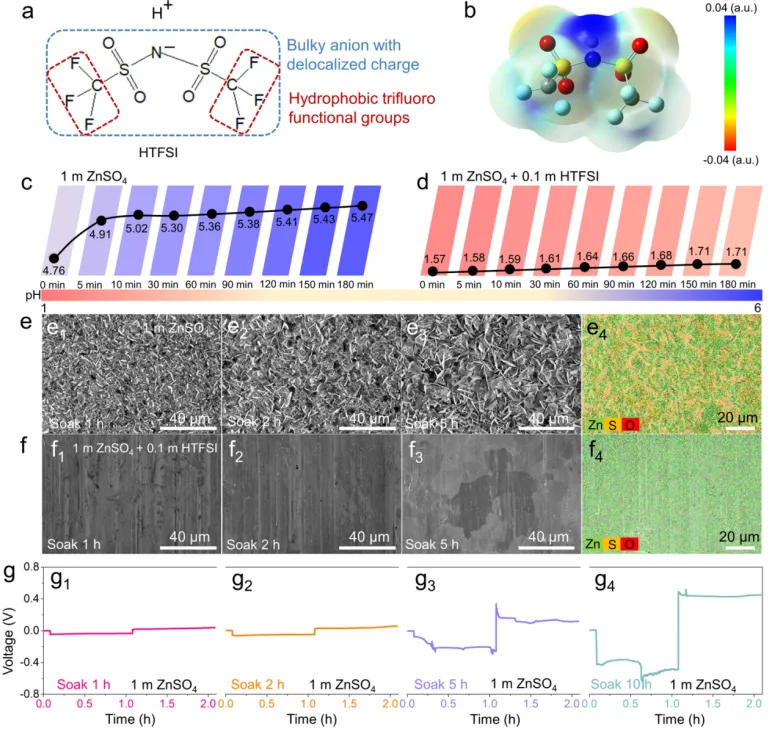
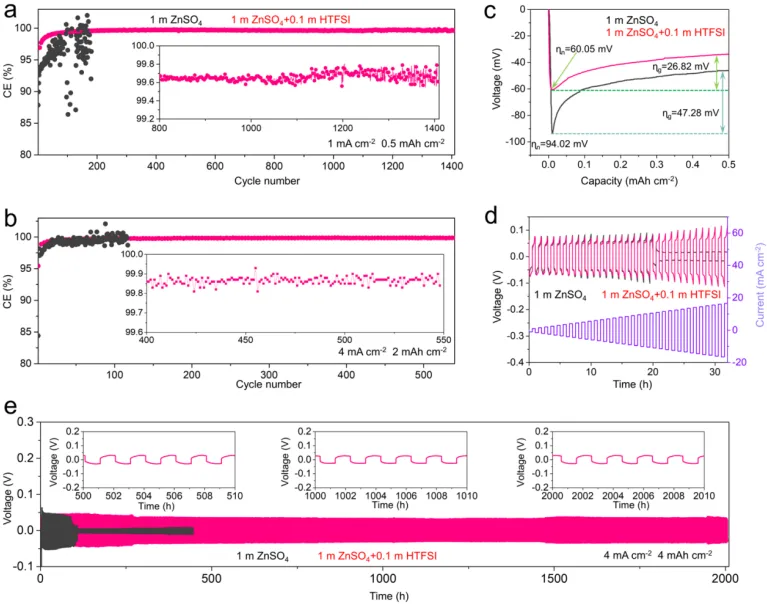
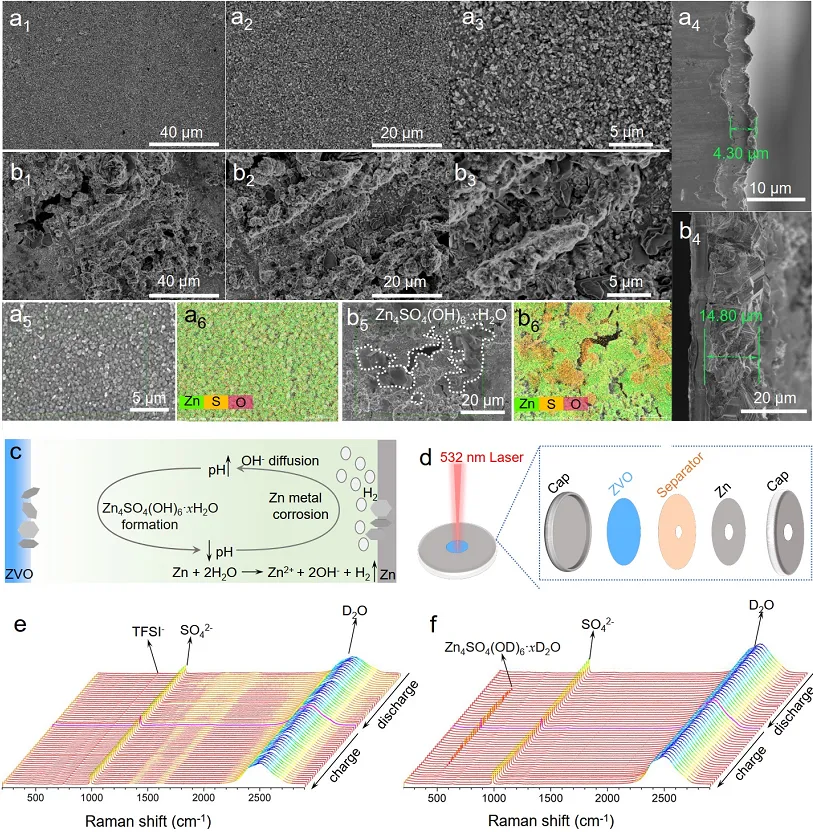
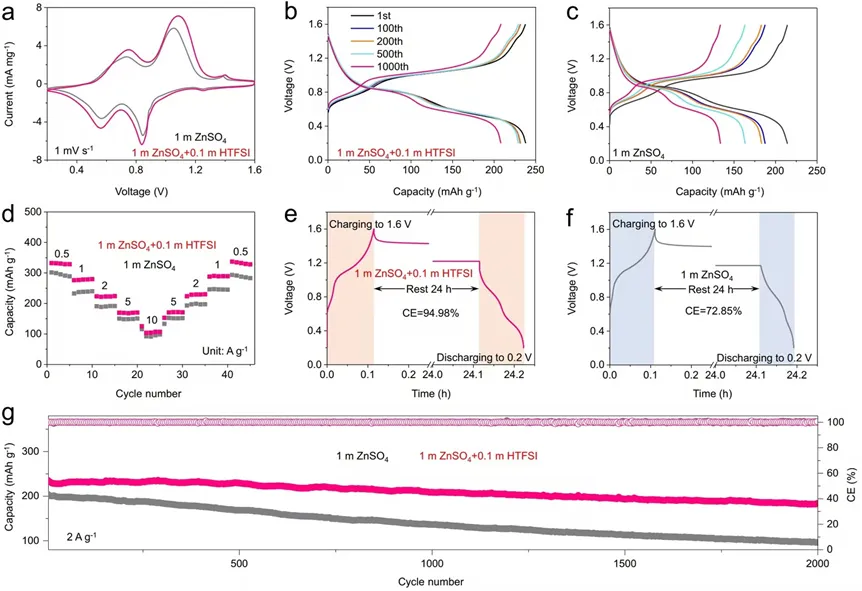
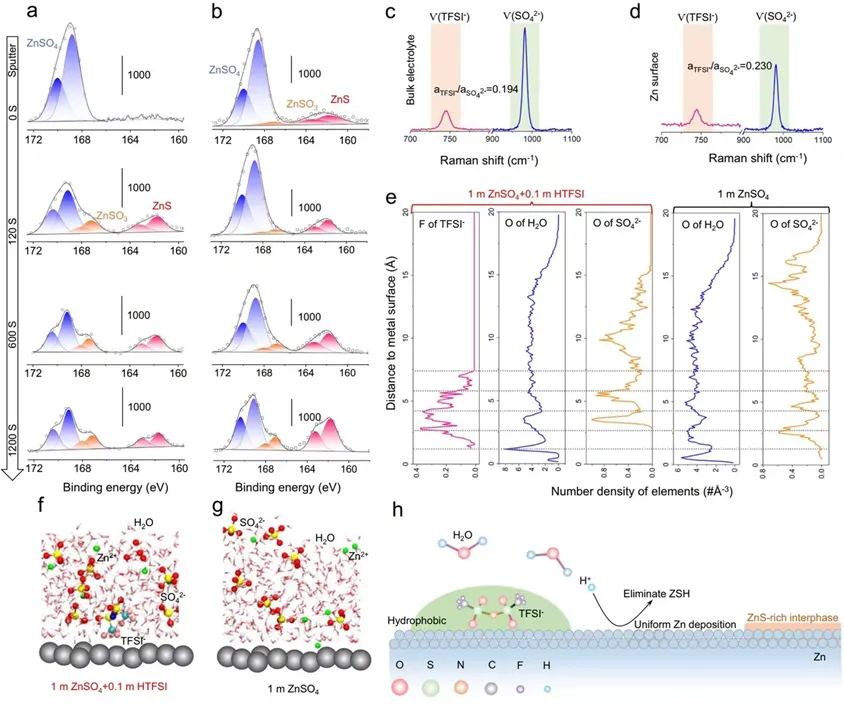
导语 成果 在锌表面富集碱性氢氧根离子很容易诱导形成导电性差的副产物沉积,例如在典型硫酸盐电解质中的Zn4SO4(OH)6·xH2O(ZSH)(图1a)。电池运行前的静置期间产生的副产物随机分布在表面上,导致随后的不均匀锌金属沉积和枝晶生长(图1b)。利用强Brønsted酸清理锌金属表面碱性副产物,则可能帮助后续均匀的锌金属沉积,尽管质子可能与锌金属发生反应,但它也会避免OH¯的形成,从而抑制在锌表面沉淀碱性副产物,为锌的均匀沉积铺平道路(图1d)。 图1 锌表面腐蚀副产物形成及抑制示意图 图2 自腐蚀对电解液pH值、电极表面产物和锌沉积的影响 添加0.1 m HTFSI电解液展现出更好的锌负极稳定性和可逆性。添加过少的HTFSI将产生有限的效果,而添加过多的HTFSI将引发无法控制的析氢副反应。1 m ZnSO4+0.1 m HTFSI电解质中Zn沉积/剥离CE表现出快速稳定,在最初的40个循环内达到了99%。随后,在1400个循环内达到了99.7%的CE。引入HTFSI后锌在Cu基底上的成核过电位和生长过电位均降低。此外,使用HTFSI的Zn||Zn电池表现出稳定的极化约30.5 mV和长达2200小时的超长循环寿命,比不添加HTFSI的电池寿命长20倍(图3e)。HTFSI的添加也显著改善了电池倍率性能,在当前密度高达17 mA cm-2时表现出稳定的放电和充电电压曲线。 图3 不同电解液中锌沉积/剥离的电化学测试研究 在1 m ZnSO4+0.1 m HTFSI电解质中,研究人员发现了密集、均匀、纳米尺寸的锌沉积物(图4a),厚度为4.3 µm,而在1 m ZnSO4电解质中呈现出厚度为14.8 µm的苔藓状锌生长(图4a4, b4)。此外,EDS及XRD结果显示, 1 m ZnSO4+0.1 m HTFSI电解液中未检测到ZSH,明显区别于1 m ZnSO4电解液。另一方面,1 m ZnSO4电解液中OH-也会扩散到正极,这将在正极表面形成ZSH并损害电池的循环稳定性。在HTFSI存在的情况下,原位拉曼结果显示正极表面没有明显变化(图4e),总结以上结果,在引入HTFSI后,负极及正极上均未检测到腐蚀副产物ZSH的形成。 图4 负极和正极的表征 在1 m ZnSO4电解液中,Zn||ZVO全电池观察到了显著容量损失,而Zn|1 m ZnSO4+0.1 m HTFSI|ZVO的循环性也得到了极大的改善。而Zn|1 m+0.1 m HTFSI|ZVO在不同电流密度下表现出更高的比容量。对全电池的自放电行为进行了探究。静置24小时后,Zn|1 m ZnSO4+0.1 m HTFSI|ZVO保持了94.98%的原始容量,自放电现象远低于Zn|1 m ZnSO4|ZVO的(72.85%)。 图5 Zn||ZVO全电池的电化学性能 S 2p光谱证实了在1 m ZnSO4+0.1 m HTFSI电解液中,锌金属将自发形成ZnS。ZnS组分可能源自于SO42−的还原,而非TFSI-阴离子,因为F 1s XPS谱图中没有氟相关物种。尽管ZnF2通常被认为是锌负极的有利SEI组分,值得注意的是ZnF2在水中的溶解度远高于ZnS(溶解度常数Ksp=3.04*10−2 vs 2.5*10−22,25 ℃)。因此,ZnS富集的SEI层可能更有效地隔离活性Zn免受电解质腐蚀。 图6 在1m ZnSO4+0.1m HTFSI电解液中对Zn|电解液界面的研究 总之,在电池静置期间,HTFSI的作用机制主要可归因于以下两个方面: (1) 强Brønsted酸的添加可以防止Zn表面上腐蚀产物的积累; (2) 在Zn表面存在HTFSI形成了疏水的微环境,诱导了ZnS的形成并防止了Zn电极的进一步腐蚀。 这两个方面都与TFSI¯阴离子的性质密切相关,因为具有疏水-三氟甲基基团的庞大结构不仅可以分散负电荷以增加质子给予能力,还可以促进Zn表面形成疏水界面以抑制进一步的电解质腐蚀。 结语
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414